Методические рекомендации к теме
Физико-химический анализ основан на зависимости качественного и количественного содержания элементов от какой-либо измеряемой физической величины (аналитического сигнала). Для проведения анализа необходимо выразить эту зависимость в виде графика (калибровочного) или таблиц. Для построения графиков пользуются серией стандартных растворов с точно известным содержанием определяемого элемента. Классификация методов физико-химического анализа: 1) Оптические методы основаны на измерении оптических свойств вещества. 2) Хроматографические основаны на использовании способности различных веществ к избирательной сорбции. 3) Электрохимические - на измерении электрохимических свойств веществ. 4) Радиометрические – на измерении радиоактивных свойств веществ. 5) Масс-спектрометрические - на излучении ионизированных фрагментов веществ и т.д. Рассмотрим некоторые основные физико-химические методы, применяемые в сельскохозяйственной практике. Пламенная фотометрия (фотометрия пламени) Метод пламенной фотометрии применяется как для открытия химических элементов, так и в количественных определениях в двух вариантах: эмиссионная пламенная фотометрия (пламенно-эмиссионный анализ) и абсорбционная пламенная фотометрия (пламенно-абсорбционный, атомно-абсорбционный анализ). Эмиссионная пламенная фотометрия (спектрометрия) представляет собой разновидность эмиссионного спектрального анализа. Анализируемый раствор, содержащий открываемый или определяемый химический элемент в виде его соединения, вносят в пламя горелки, распыляя его в форме аэрозоля с помощью простого пульверизатора. При температуре пламени анализируемое вещество разлагается и атомизируется. Образующиеся атомы термически возбуждаются, а затем (по истечении очень короткого времени жизни возбужденного состояния) излучают энергию возбуждения в виде фотона, что регистрируется в форме соответствующей спектральной линии пламенным фотометром. Линейчатые эмиссионные спектры атомов всех химических элементов хорошо изучены и имеются в справочниках. Атомно-абсорбционная пламенная фотометрия (атомно-абсорбциоиная пламенная спектрометрия) состоит в следующем. В пламя горелки вносится анализируемый раствор (например, распыляется в форме аэрозоля), содержащий соединение открываемого или определяемого химического элемента (натрия, калия, кальция и т. д.). В пламени горелки при высокой температуре частицы анализируемого образца разлагаются и атомизируются. Через это пламя пропускают луч света от источника возбуждения, содержащий резонансное излучение открываемого или определяемого элемента. В качестве источника возбуждения применяют лампы с полым катодом, в состав светящейся плазмы которых входят возбужденные (находящиеся в возбужденном электронном состоянии) атомы данного элемента, способные излучать свет, с длиной волны резонансного перехода. Атомы открываемого или определяемого элемента, образовавшиеся в пламени горелки при термическом разложении анализируемого образца, могут поглощать (если они находятся в невозбужденном электронном состоянии) только фотоны с длиной волны резонансного излучения этого же элемента. Например, невозбужденные атомы натрия могут поглощать только резонансное излучение атомов натрия, но не атомов другого химического элемента. Вследствие частичного поглощения невозбужденными атомами в зоне пламени интенсивность резонансного излучения (источника возбуждения) уменьшается при прохождении через пламя тем сильнее, чем больше поглощающих атомов присутствуют в зоне пламени, т. е. чем выше концентрация анализируемого раствора по определяемому элементу. Интенсивность резонансного излучения (источника возбуждения), прошедшего через пламя, регистрируется и измеряется спектральным прибором — атомно-абсорбционным пламенным фотометром или спектрофотометром. Если интенсивность резонансного излучения не уменьшается после прохождения его через пламя с анализируемым образцом, то это означает, что анализируемый образец не содержит данный элемент, резонансное излучение которого регистрируется пламенным фотометром. Если же интенсивность резонансного излучения уменьшается после прохождения через пламя с анализируемым образцом, то это указывает на присутствие данного химического элемента в анализируемом образце. В некотором интервале изменения концентраций определяемого элемента в анализируемом растворе уменьшение интенсивности резонансного излучения пропорционально при определенных условиях числу поглощающих атомов в зоне пламени и, следовательно, пропорционально концентрации раствора. На этом основано количественное определение содержания данного элемента в анализируемом образце. Спектрофотометрия. Из спектральных методов анализа наиболее широко применяют в агрохимической практике спектрофотометрию, основанную на измерении интенсивности светового потока, прошедшего через окрашенный раствор. Данный метод абсорбционного молекулярного анализа основан на использовании спектральных приборов – спектрофотометров, позволяющих регистрировать световые потоки в широком интервале изменения длин волн от 185 нм до 1100 нм, т.е. в видимой и ближней ИК области спектра. Измеряя светопоглощение окрашенного раствора (фотоколориметрический анализ), определяют содержание окрашенного вещества в испытуемом растворе. Существует зависимость между интенсивностью окраски раствора и содержанием в этом растворе окрашенного вещества. Эта зависимость (закон Бугера — Ламберта — Бера) выражается уравнением: D= εCl, где D -оптическая плотность или экстинкция, ε –коэффициент экстинкции, C –концентрация вещества, l -длина поглощающего слоя, см. Закон справедлив только для поглощения монохроматического светового потока с постоянной длиной волны. Для получения монохроматического излучения используется дифракционная решетка или светофильтр, которыми снабжены приборы. При фотоколориметрических определениях, определяя концентрацию испытуемого раствора, предварительно строят так называемую калибровочную кривую. Для этого пользуются серией эталонных растворов различной концентрации определяемого вещества. Измеряя оптическую плотность эталонных растворов, строят графическую зависимость, откладывая на оси абсцисс концентрацию С, а на оси ординат оптическую плотность D (рис.16).
|
 С
С
Рисунок 16. Калибровочная кривая
Имея такую кривую, при определении концентрации испытуемого раствора достаточно измерить его светопоглощение и по калибровочной кривой найти значение концентрации, соответствующее найденному светопоглощению. Потенциометрический метод,основанный на измерении электродвижущих сил (ЭДС) обратимых гальванических элементов, используют для определения содержания веществ в растворе и измерения различных физико-химических величин. В потенциометрии обычно применяют гальванический элемент, включающий два электрода, которые могут быть погружены в один и тот же раствор (элемент без переноса) или в два различных по составу раствора, имеющих между собой жидкостной контакт (цепь с переносом). Электрод, потенциал которого зависит от активности (концентрации) определяемых ионов в растворе, называется индикаторным. Для измерения потенциала индикаторного электрода в раствор погружают второй электрод, потенциал которого не зависит от концентрации определяемых ионов. Такой электрод называется электродом сравнения.Величину ЭДС можно рассчитать по разности потенциалов этих электродов. Зависимость величины электродного потенциала (ЭП) от активности ионов в растворе выражается уравнением Нернста 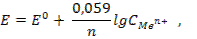 где Ео - стандартный электродный потенциал; п - число электронов (ē), участвующих в реакции;
где Ео - стандартный электродный потенциал; п - число электронов (ē), участвующих в реакции; 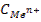 - концентрация, моль/л. В потенциометрическом методе анализа используют два основных класса электродов: - электроды, на межфазных границах которых протекают реакции с участием электронов, так называемые электронообменные (электроды первого, второго рода и окислительно-восстановительные); - электроды, на межфазных границах которых протекают ионообменные реакции. Такие электроды называют мембранными,или ионообменными,их называют также ионоселективными. Обратимые электроды - электроды, у которых скачки потенциалов зависят от концентрации в соответствии с термодинамическими уравнениями. На обратимых электродах быстро устанавливается равновесие, и скачки потенциалов остаются неизменными во времени. При прохождении электрического тока скачки потенциалов не должны значительно изменяться; а после выключения тока быстро должно устанавливаться равновесие. Электроды, не удовлетворяющие этим требованиям, называются необратимыми. В потенциометрии используют обратимые электроды. Электроды I рода — электроды, находящиеся в равновесии с катионами, одноименными с металлом, и обратимые по отношению к ним. Простейший электронообменный электрод — металлическая пластинка, погруженная в раствор или расплав электролита Zn/Zn2+; Сu/Сu2+ и т. д. В качестве электрода сравнения используют стандартный водородный электрод (СВЭ) — электрод I рода. Его потенциал определяется величиной рН и при комнатной температуре равен: Е = Ео + 0,0591g[H+] = -0,059рН Стандартный водородный электрод (СВЭ) неудобен в работе, его заменяют электродами II рода — насыщенным каломельным электродом (н.к.э.) и хлорсеребряным (х.с.э.). Электроды II рода — электроды, состоящие из металлической пластинки, покрытой малорастворимой солью этого металла, и обратимые по отношению к анионам соли: а) хлорсеребряные электроды состоят из серебряной проволоки, покрытой малорастворимой в воде солью AgCl , погружённой в водный раствор КСl. На электроде протекает реакция АgCl +ē ↔ Ag+ + Cl-; б) каломельный Нg/Hg22+,КСl состоит из металлической ртути, покрытой пастой малорастворимого Hg2Cl2 - каломели, контактирующие с водным раствором КСl. Мембранные (ион-селективные) электроды - электроды обратимые по тем или иным ионам, сорбируемым твердой или жидкой мембраной. Реальный потенциал таких электродов зависит от активности тех ионов в растворе, которые сорбируются мембраной. Мембранные электроды используют в качестве индикаторных при определении различных катионов (Li+, Na+, K+, Mg2+, Ca2+, Cd2+ и т.д.) и анионов (F-, Cl-, S2-, NO3- и др.). Среди ионоселективных электродов наибольшее применение получили стеклянный и хингидронный электроды, предназначенные для измерения рН (рис. 17).
- концентрация, моль/л. В потенциометрическом методе анализа используют два основных класса электродов: - электроды, на межфазных границах которых протекают реакции с участием электронов, так называемые электронообменные (электроды первого, второго рода и окислительно-восстановительные); - электроды, на межфазных границах которых протекают ионообменные реакции. Такие электроды называют мембранными,или ионообменными,их называют также ионоселективными. Обратимые электроды - электроды, у которых скачки потенциалов зависят от концентрации в соответствии с термодинамическими уравнениями. На обратимых электродах быстро устанавливается равновесие, и скачки потенциалов остаются неизменными во времени. При прохождении электрического тока скачки потенциалов не должны значительно изменяться; а после выключения тока быстро должно устанавливаться равновесие. Электроды, не удовлетворяющие этим требованиям, называются необратимыми. В потенциометрии используют обратимые электроды. Электроды I рода — электроды, находящиеся в равновесии с катионами, одноименными с металлом, и обратимые по отношению к ним. Простейший электронообменный электрод — металлическая пластинка, погруженная в раствор или расплав электролита Zn/Zn2+; Сu/Сu2+ и т. д. В качестве электрода сравнения используют стандартный водородный электрод (СВЭ) — электрод I рода. Его потенциал определяется величиной рН и при комнатной температуре равен: Е = Ео + 0,0591g[H+] = -0,059рН Стандартный водородный электрод (СВЭ) неудобен в работе, его заменяют электродами II рода — насыщенным каломельным электродом (н.к.э.) и хлорсеребряным (х.с.э.). Электроды II рода — электроды, состоящие из металлической пластинки, покрытой малорастворимой солью этого металла, и обратимые по отношению к анионам соли: а) хлорсеребряные электроды состоят из серебряной проволоки, покрытой малорастворимой в воде солью AgCl , погружённой в водный раствор КСl. На электроде протекает реакция АgCl +ē ↔ Ag+ + Cl-; б) каломельный Нg/Hg22+,КСl состоит из металлической ртути, покрытой пастой малорастворимого Hg2Cl2 - каломели, контактирующие с водным раствором КСl. Мембранные (ион-селективные) электроды - электроды обратимые по тем или иным ионам, сорбируемым твердой или жидкой мембраной. Реальный потенциал таких электродов зависит от активности тех ионов в растворе, которые сорбируются мембраной. Мембранные электроды используют в качестве индикаторных при определении различных катионов (Li+, Na+, K+, Mg2+, Ca2+, Cd2+ и т.д.) и анионов (F-, Cl-, S2-, NO3- и др.). Среди ионоселективных электродов наибольшее применение получили стеклянный и хингидронный электроды, предназначенные для измерения рН (рис. 17).
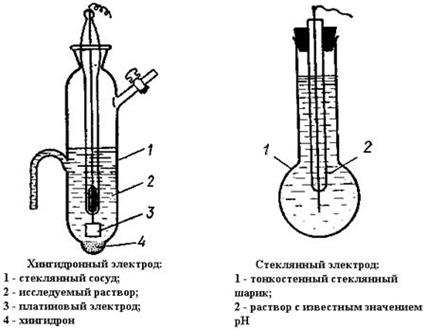
Рисунок 17. Мембранные электроды
Хингидронный электрод состоит из платиновой проволоки, погруженной в раствор соляной кислоты, насыщенный хингидроном (соединение состава С6Н4О2·С6Н4(ОН)2). Схематическое обозначение хингидронного электрода: Pt│хингидрон, HCl. На хингидронном эдектроде протекает окислительно-восстановительная реакция: С6Н4О2 + 2Н+ + 2ē = С6Н4(ОН)2 Потенциал хингидронного электрода при комнатной температуре равен: Е = Ео – 0,059рН. Хингидронный электрод нельзя применять в присутствии сильных окислителей и восстановителей.
11.3 Лабораторная работа (резервная)«Фотометрическое определение меди»Цель работы: приобретение навыков работы на КФК-2, приготовления стандартных растворов. Приборы и оборудование: спектрофотометр КФК-2, колбы мерные емкостью 50 и 1000 мл, бюретки, мерные цилиндры емкостью 10 мл. Реактивы: раствор гидроксида аммония (разбавленный 1:3), концентрированная серная кислота, х. ч. сульфат меди (II) CuSO4·5H2O Выполнение работы. Определение меди проводят аммиачным методом. Он основан на образовании ионом Сu2+ с аммиаком комплекса [Сu(NH3)4]2+ окрашенного в интенсивно-синий цвет.
1. Приготовление раствора сравнения для построения градуиравочного графика. 10 мл разбавленного (1:3) гидроксида аммония переносят в мерную колбу вместимостью 50 мл, добавляют одну каплю концентрированной серной кислоты (плотность 1,84 г/см3) и доводят дистиллированной водой до метки (нулевой раствор).
2. Приготовление стандартного раствора соли меди. 3,927 г х. ч. сульфата меди CuSO4·5H2O переносят в мерную колбу вместимостью 1000 мл, растворяют, приливают 5 мл концентрированной H2SO4 (ρ = 1,84 г/см3) и доводят водой до метки, 1 мл этого раствора содержит 1 мг иона Сu2+
3. Построение градуировочного графика. В шесть мерных колб вместимостью по 50 мл отмеряют пипетками соответственно 25, 20, 15, 10, 5 и 3 мл стандартного раствора соли меди. В каждую прибавляют по 10 мл разбавленного (1:3) раствора гидроксида аммония и доводят объем дистиллированной водой до метки. Измерение оптической плотности D начинают с раствора, имеющего наибольшую концентрацию меди. Для этого раствор из колбы наливают в кювету с рабочей длиной 1 см и измеряют оптическую плотность раствора при красном светофильтре (670 нм). Результаты оформляют в виде таблицы 16.
Таблица 16 – Концентрация (С) и оптическая плотность (D) стандартных растворов
| № колбы | ||||||
| Объем стандартного раствора (V, мл) | ||||||
| Концентрация иона Сu2+ (C, мг/мл) | 0,5 | 0,4 | 0,3 | 0,2 | 0,1 | 0,06 |
| Оптическая плотность (D) |
По результатам измерений строят градуировочный график, откладывая по горизонтальной оси известные концентрации иона Сu2+ , а по вертикальной - соответствующие им оптические плотности.
4. Ход определения меди в контрольном растворе. В мерную колбу с определенным количеством испытуемого раствора добавляют 1 каплю концентрированной серной кислоты, нейтрализуют 10 мл разбавленного раствора (1:3) гидроксида аммония и доводят объем в колбе водой до метки. Раствор тщательно перемешивается, наполняется им кювета с рабочей длиной 1 см и измеряют оптическую плотность его при красном светофильтре, т. е. при тех же условиях, при каких был получен градуировочный график. Зная величину оптической плотности, находят по графику концентрацию иона Сu2+ в миллиграммах на 1 мл раствора. Массу меди (в мг) в анализируемом растворе рассчитывают по формуле: mCu2+ = C · V, где С - концентрация иона меди ( в мг/мл; V – объем раствора (50 мл). Результат анализа:в контрольном растворе объемом 50 мл содержится ….. мг меди Cu2+.
СПИСОК ЛИТЕРАТУРЫ
1. Ахметов, Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М.: Высшая школа, 2006. – 743 с. 2. Глинка, Н.Л. Задачи и упражнения по общей химии: Учеб. пособие для вузов / Н.Л. Глинка; под ред. В.А. Рабиновича и Х.М. Рубиной. – 26-е изд., стер. – Л.: Химия, 1988. – 272 с.: ил.
3. Глинка, Н.Л. Общая химия / Н.Л. Глинка. - Л. : Химия, 2004. – 728 с. 4. Князев, Д.А. Неорганическая химия: Учеб. для вузов /Д.А. Князев, С.Н. Смарыгин. – 2-е изд., перераб. и доп. – М.: Дрофа, 2004. – 592 с.: ил. 5. Лидин, Р.А. Задачи по общей и неорганической химии: учеб. пособие для студентов высш. учеб. заведений / Р.А. Лидин, В.А. Молочко, Л.Л. Андрева; под ред. Р.А. Лидина. – М.: Гуманитар. Изд. Центр ВЛАДОС, 2004.–383с. 6. Платонов, Ф.П. Практикум по неорганической химии: Учебное пособие для с-х и биол. специальностей вузов / Ф.П. Платонов, З.Е. Дейкова. – 3-е изд., перераб. и доп. – М.: Высшая школа, 1985. – 255с.: ил.
7. Романцева, Л.М. Сборник задач и упражнений по общей химии / Л.М. Романцева, З.Л. Лещинская, В.А. Суханова. – М.: Высшая школа, 1991. – 288 с. 8. Харитонов Ю.Я. Аналитическая химия (аналитика). В 2 кн. Кн.1. Общие теоретические вопросы. Качественный анализ. Учеб.для вузов. – 2-е изд., испр. – М.: Высш. шк., 2003. – 615 с., ил.
Дата добавления: 2017-01-13; просмотров: 1526;
