Электронное строение атома, электронные формулы атомов и электронно-графические формулы.
Строение атома описывается с помощью схемы электронного строения атома, электронной формулы атома, электронно-графической формулы атома.
Схемы электронного строения атомов показывают распределение электронов по энергетическим уровням.
Например, натрий
К L М
11Na +ll) ) )
2 8 1
Распределение электронов в атомах по энергетическим подуровням показывают электронные формулы (конфигурации).
11Na ls2 2s2 2p6 3s1
Структуру электронных оболочек атомов изображают графически при помощи энергетических ячеек (электронных структур). Понятие об энергетической ячейке соответствует понятию об энергетическом состоянии электрона, характеризуемом квантовыми числами n,l,m. Ячейка обозначается квадратиком, электрон внутри ячейки - стрелкой. Каждая ячейка может вместить одну электронную пару.
Например, структура электронной оболочки для атома алюминия будет иметь следующий вид:
3s2 3p6
| 2s2 | 2p6 | 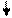 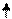
|  _ _
| ||||||
| 1s2 | 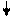 
| 
| 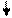
| 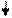 
| 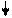 
| ||||
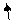 
| |||||||||
По энергетическим соображениям 1s-орбиталь заполняется раньше, чем орбиталь 2s, которая в свою очередь заполняется раньше, чем 2р-орбиталь. Порядок заполнения трех 2р-орбиталей определяется правилом Гунда, согласно которому ни одна из р-орбиталей данной оболочки не может быть занята двумя электронами до тех пор, пока все р-орбитали этой оболочки не будут содержать по одному электрону.
Например, для атома фосфора, электронная формула которого
1s2 2s2 2p6 3s2 3р3 , распределение по ячейкам будет иметь следующий вид:
 
| p | |||||||||
 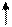
| 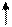  
| 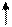  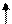
|   
| d | ||||||
 
| ||||||||||
n=1
n=2
n=3
Основное состояние атома фосфора.
Находясь в одной ячейке, электроны связаны друг с другом в силу замыкания их магнитных полей, образованных при движении электрона по замкнутой орбитали; энергетическое состояние электрона, обусловленное орбитальными магнитным моментом электрона, характеризуется третьим квантовым числом - магнитным (me). При сообщении энергии извне эту пару можно разъединить, то есть распарить, и из нуль-валентной сделать валентными:
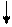  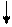 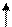
| 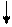 
| 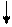  p p
| 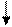 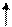
| |||||||
| d | ||||||||||

| 
| 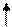
| 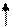
| 
| ||||||
s
n=1
n=2
n=3
Пятивалентное возбужденное
состояние атома фосфора
Каждый электрон обладает еще и внутренним движением. Эффект, вызванный внутренним движением электрона вокруг собственной оси, характеризуются четвертым квантовым числом - спиновым ms.
| Символ элемента, порядковый номер, название | Схема
электронного
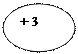 строения строения
| Электронная формула | Электронно-графическая формула | |||||||||||||||||||||||||
| Элементы II периода | ||||||||||||||||||||||||||||
| 3Li Литий |
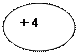 ))
2 1 ))
2 1
| ls22sl |
1s
| |||||||||||||||||||||||||
| 4Be Берилий | 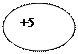 К L
))
2 2
К L
))
2 2
| ls22s2 |
| |||||||||||||||||||||||||
| 5B Бор | К L )) 2 3 | 1s22s22p1 |
| |||||||||||||||||||||||||
| 6C Углерод |
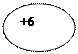 К L
))
2 4 К L
))
2 4
| 1s22s22p2 |
| |||||||||||||||||||||||||
| 7N Азот | 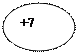 К L
К L
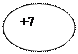 ))
2 5 ))
2 5
| 1s22s22p3 |
|
Строение элементов II, III и IV периодов
 |
| Элементы III периода | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 11Na Натрий | 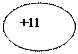 KLM
)))
2 8 1 KLM
)))
2 8 1
| 1s22s22p63s1 |
1 s
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 13Аl Алюминий | KLM
 )))
2 8 3 )))
2 8 3
| 1s22s22p63s23p1 |
1s
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 18 Аr Аргон |
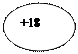 KLM
)))
2 8 8 KLM
)))
2 8 8
| 1s22s22p63s23p6 |
1s
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Элементы IV периода | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 13К Калий | 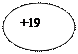 KLMN
))))
2 8 8 1 KLMN
))))
2 8 8 1
| 1s22s22p63s23p64s1 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 20Са Кальций | KLMN
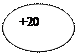 ))))
2 8 8 2 ))))
2 8 8 2
| 1s22s22p63s23p64s2 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2lSc Скандий | KLMN
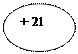 ))))
2 8 9 2 ))))
2 8 9 2
| ls22s22p63s23p64s23d1 или ls22s22p63s23p63d14s2 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 24Сr Хром | 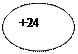 KLMN ))))
2 8 13 1 KLMN ))))
2 8 13 1
| ls22s22p63s23p64s13d5 |
|
| 9CU Медь | KLMN )))) 2 8 18 1 | ls22s22p63s23p64s23d10 |
| ||||||||||||||||||||||||||||||||||||||||||||||||
30Zn 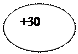 Цинк Цинк
| KLMN )))) 2 8 18 2 | ls22s22p63s23p64s23d10 |
| ||||||||||||||||||||||||||||||||||||||||||||||||
| 31Ga Галлий | KLMN
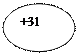 ))))
2 8 18 3 ))))
2 8 18 3
| 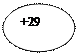 ls22s22p63s23p64s23d10p1 ls22s22p63s23p64s23d10p1
|
|
Дата добавления: 2016-11-22; просмотров: 5427;
