Принцип расчета показателя ЧБНЛ при его отсутствии в публикации
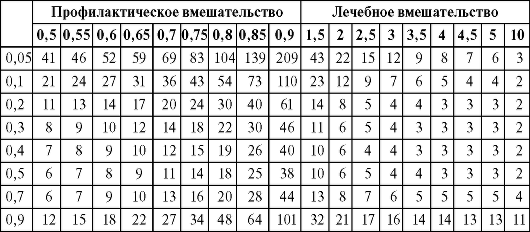
Риск развития исхода (вероятность) выражается по отношению к общей выборке определенного размера, например когда 15 случаев одного исхода наблюдаются в выборке из 100 человек, риск этого исхода равен 0,15. В этом случае шанс такого исхода в выборке рассчитывается как число развившихся исходов по отношению к числу неразвившихся (например, 15 к 85 или 0,17). Тогда отношение шансов рассчитывается просто как шанс исхода в группе лечения, деленный на шанс этого исхода в группе сравнения. Поэтому если в систематизированном обзоре приводится только отношение шансов, но нет значений ЧБНЛ, последний показатель можно рассчитать по табл. 3.3. Для этого необходимо выбрать колонку с наиболее близким к опубликованному значением отношения шансов и строку с самым близким к ожидаемому значением частоты исхода, а затем на их пересечении найти соответствующее значение ЧБНЛ. В левой ее части приведены значения отношения шансов меньше 1,0. Это означает, что при профилактических вмешательствах, когда исход - это возникновение заболевания, рецидив, осложнения или ухудшение течения болезни, интересующий исход в группе лечения встречается реже, чем в группе сравнения. В правой части рисунка значения отношения шансов больше 1,0 - значит, интересующий исход чаще встречается в группе лечения, что типично для исследований по изучению эффективности лечебных вмешательств (где исход - это полное выздоровление, ремиссия, отсутствие осложнений или стабилизация течения заболевания).
Таблица позволяет определить, как различная частота исхода влияет на величину ЧБНЛ при определенном значении отношения шансов.
Таблица 3.3.Расчет ЧБНЛ по величине отношения шансов
 При экстраполяции данных систематизированного обзора врач прежде всего должен оценить степень его соответствия той группе пациентов, для которой был выявлен положительный эффект вмешательства. Несомненно, что личный опыт врача и существующие стандарты лечения должны быть учтены при принятии окончательного решения. Представление об эффективности препаратов может изменяться по мере появления дополнительных данных после завершения крупных рандомизированных контролируемых испытаний. Появляются новые данные и меняются результаты систематизированных обзоров. Поэтому в практической работе необходимо использовать наиболее свежие из них. Главное состоит в том, что систематизированные обзоры могут предоставлять объективную информацию, позволяющую пациенту и врачу прогнозировать эффективность и возможные последствия от конкретного вмешательства еще до начала лечения.
При экстраполяции данных систематизированного обзора врач прежде всего должен оценить степень его соответствия той группе пациентов, для которой был выявлен положительный эффект вмешательства. Несомненно, что личный опыт врача и существующие стандарты лечения должны быть учтены при принятии окончательного решения. Представление об эффективности препаратов может изменяться по мере появления дополнительных данных после завершения крупных рандомизированных контролируемых испытаний. Появляются новые данные и меняются результаты систематизированных обзоров. Поэтому в практической работе необходимо использовать наиболее свежие из них. Главное состоит в том, что систематизированные обзоры могут предоставлять объективную информацию, позволяющую пациенту и врачу прогнозировать эффективность и возможные последствия от конкретного вмешательства еще до начала лечения.
Для профилактических вмешательств ЧБНЛ рассчитывается по формуле:
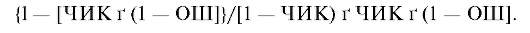 Для лечебных вмешательств ЧБНЛ рассчитывается по формуле:
Для лечебных вмешательств ЧБНЛ рассчитывается по формуле:
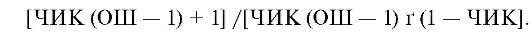 Систематические обзоры подразделяются на качественные и количественные. Последние отличаются использованием специальных статистических методов для обобщения результатов (мета-анализ)
Систематические обзоры подразделяются на качественные и количественные. Последние отличаются использованием специальных статистических методов для обобщения результатов (мета-анализ)
 Рис. 3.2.Взаимодействие систематических обзоров и мета-анализа
Рис. 3.2.Взаимодействие систематических обзоров и мета-анализа
различных исследований с целью получения вывода об эффективности вмешательства или диагностического метода. Часто систематический обзор, выполненный с использованием статистических методов, также называют мета-анализом, однако это не совсем корректно. Их соотншение представлено на рис. 3.2.
Мета-анализ
Одной из разновидностей систематизированных обзоров является мета-анализ. Часто мета-анализ рассматривается как высшая ступень доказательности и становится основой для выбора наиболее эффективных лечебно-профилактических и диагностических вмешательств. Мета-анализ, появившийся в конце 1980-х годов, сегодня относится к одной из самых популярных и быстро развивающихся методик системной интеграции результатов отдельных научных исследований. Например, в Великобритании до 50% всех используемых сегодня методов лечения заболеваний внутренних органов основаны на результатах рандомизированных контролируемых испытаний (РКИ), а также соответствующих мета-анализов. Сегодня мета-анализ - это «объединение результатов различных исследований, складывающееся из качественного компонента (например, использование таких заранее определенных критериев включения в анализ, как полнота данных, отсутствие явных недостатков в организации исследования и
т.д.) и количественного компонента (статистическая обработка имеющихся данных)». В то же время I. Chalmers и D.G. Altman в монографии «Систематические обзоры» характеризуют мета-анализ как «количественный систематический обзор литературы или количественный синтез первичных данных с целью получения суммарных статистических показателей».
Целью мета-анализа является оценка эффективности изучаемого вмешательства, а также выявление, изучение и объяснение неоднородности или гетерогенности в результатах исследований и подгруппах пациентов. Он должен представить точечные и интервальные (95% доверительный интервал) оценки обобщенного эффекта вмешательства.
Как указывалось выше, в мире ежегодно публикуется более 2,5 миллиона медицинских статей, не считая материалов многочисленных национальных и международных конференций, книг. Естественно, в этой ситуации велика потребность в анализе и синтезе имеющейся информации. Ее анализ по типу литературного обзора для журнала или диссертации носит чисто описательный и субъективный характер, хотя и является предпосылкой для проведения мета-анализа после актуализации некой проблемы. Главный недостаток такого подхода состоит в том, что он не использует строго научные и математические методики. Все это приводит к появлению так называемой β-ошибки (ошибка второго рода - ложное утверждение об отсутствии различий между эффективностью сравниваемых методов лечения, когда на самом деле они различны) из-за противоречивых результатов исследований и недостаточного числа пациентов в них. Примеров расхождения результатов описательного обзора литературы и ее метаанализа очень много (публикация вывода лауреата Нобелевской премии профессора Л. Полинга о снижении заболеваемости простудой в результате применения аскорбиновой кислоты, эффективность антиоксидантов в профилактике сердечно-сосудистой патологии, целесообразность профилактики нарушений ритма с использованием лидокаина в остром периоде инфаркта миокарда, возможность снижения риска сердечно-сосудистой патологии у женщин на фоне заместительной гормональной терапии). Ни один из этих выводов впоследствии не был подтвержден результатами соответствующих мета-анализов. В то же время кумулятивный мета-анализ 33 клинических исследований мог еще в 1973 г. (почти за 20 лет до широкого внедрения в практику внутривенного тромболизиса) сделать рутинной практику введения
стрептокиназы при остром инфаркте миокарда.
Однако существуют и противоположные примеры. В качестве одного из них можно привести дискуссию середины 1990-х годов прошлого века о целесообразности и безопасности применения антагонистов кальция при артериальной гипертензии. По данным двух мета-анализов было показано их негативное влияние на риск развития инфаркта миокарда, но последующие крупные исследования ALLHAT и ASCOT полностью опровергли эти опасения, также как и новый мета-анализ BPTLC.
В целом мета-анализ позволяет более точно, чем результаты отдельно взятого клинического исследования, определить категории больных, у которых применимы полученные результаты.
На основании результатов мета-анализа часто принимаются не только лечебно-диагностические, но и управленческие решения (например, развертывание специализированных инсультных отделений, снижающих риск смертности и тяжелой инвалидизации более чем на треть). Интересно, что ни в одном из более чем 10 рандомизированных клинических исследований преимущества специализированных отделений не были доказаны.
Постоянно обновляемые мета-анализы позволяют существенно сократить время между научным открытием и широким внедрением его результатов в практику здравоохранения. В качестве примера можно привести результаты мета-анализа по применению β-адреноблокаторов при артериальной гипертензии, которые существенно сузили показания для их назначения у этой категории пациентов.
Существует два основных подхода к выполнению мета-анализа: статистический ре-анализ отдельных исследований на основании первичных данных о включенных в них пациентах и альтернативный ему, базирующийся на обобщении результатов опубликованных исследований по конкретной теме.
Главными преимуществом мета-анализа является возможность увеличения статистической мощности исследования и достоверности оценки эффекта анализируемого вмешательства, относительно низкая стоимость и оперативность его проведения.
В соответствии с рекомендациями «The Cochrane Collaboration. Preparing, maintaining and disseminating systematic reviews of the effects of health care» (The Cochrane Collaboration, UK, 1995) для анализа качества выполненного мета-анализа необходимо проанализировать следующее.
Дата добавления: 2016-09-20; просмотров: 1348;
