Методы идентификации (установления подлинности), используемые в фармакопейном анализе. Первая и вторая идентификации.
Испытание на подлинность — это подтверждение идентичности анализируемого лекарственного вещества (лекарственной формы), осуществляемое на основе требований Фармакопеи или другой НД (ФС, ФСП). Испытания выполняют физическими, химическими и физико-химическими методами. Свои особенности имеют испытания неорганических, элементорганических и органических ЛВ.
Подлинность ЛВ подтверждают показатели: описание внешнего вида, его физические свойства, физические константы и растворимость в различных растворителях. Они дают ориентировочную характеристику испытуемого ЛВ.
Физические свойства твердых ЛВ оценивают по форме кристаллов или по виду аморфного вещества, его устойчивости к свету, кислороду, содержащемуся в воздухе, гигроскопичности и степени выветривания, запаху, цвету, степени белизны. Для жидкостей устанавливают цвет, запах, летучесть, подвижность, воспламеняемость.
Также подлинность устанавливают по температуре плавления, затвердевания, кипения, вязкости, плотности, растворимости.
Растворимость — свойство газообразных, жидких и твердых веществ переходить в растворенное состояние. Растворимость в фармакопейном анализе рассматривают как свойство ЛВ растворяться в различных растворителях. Растворимость при постоянной температуре является одной из основных характеристик, с помощью которой подтверждают доброкачественность большинства ЛВ.
Химические методы установления подлинности:
1) для неорган лс: основано на обнаружении с помощью химических реакций катионов и анионов, входящих в состав их молекул: реакции осаждения (ионы серебра), окислит-восстан реа-ции (нитрит- инитрат-ионы), разложения ( карбонаты с обр-нием углекисл.газа), превращения, происходящие при нагревании (йод кристалл возгоняется)
2) для элементорганич лс: Поскольку атомы у большинства элементорганических соединений связаны ковалентно, необходимым условием испытания их подлинности является предварительная минерализация. При этом происходит частичное или полное разрушение органической части молекулы до оксида углерода (IV) и воды. Другие элементы образуют соответствующие ионы. Последние идентифицируют с помощью рассмотренных выше или иных реакций.
3) для органич лс: используются различные химические реакции органических соединений, которые дают определенный аналитический эффект (выпадение осадка, выделение газа, образование окрашнного раствора и т.д.). Напр., реак-ция нитрования (цветная), галогенирования, диазотирования и азосочетания и др.
Физико-химические методы определения подлинности: спектрофотометрия в уф- и видимой областях, ИК-спектрофотометрия, хроматографические методы др.
В некоторых частных фармакопейных статьях имеются подразделы «Первая идентификация» и «Вторая идентификация». Обычно используют первую идентификацию. Если имеется гарантия того, что данная серия субстанции была ранее сертифицирована на соответствие всем требованиям частной фармакопейной статьи, испытания из второго подраздела могут использоваться вместо испытаний из первого подраздела.
61. Общая фармакопейная статья ГФ «реакции подлинности на ионы и функциональные группы». Реакции идентификации неорганических катионов: алюминий, аммония соли, аммония соли и соли летуч оснований, висмут, железо, калий, кальций.
На алюминий: реактив тиоацетамид плюс раствор натрия гидроксида разведенный образуется гелеобразный белый осадок, растворяющийся при последующем прибавлении раствора натрия гидроксида разведенного. К полученному раствору постепенно прибавляют раствор аммония хлорида, вновь образуется гелеобразный белый осадок.
На аммония соли:К испытуемому раствору доб-т магний оксида. Через жидкость пропускают воздух и выходящий воздух направляют в смесь раствора кислоты хлористоводородной и раствора метилового красного, окраска индикатора переходит в желтую. Затем прибавляют свежеприготовленный раствор натрия кобальтинитрита; образуется желтый осадок.
НА АММОНИЯ СОЛИ И СОЛИ ЛЕТУЧИХ ОСНОВАНИЙ: к раствору аммония прибавляют раствор натрия гидроксида . При нагревании раствора выделяются пары аммиака, которые обнаруживаются по запаху и щелочной реакции .
На висмут:с сульфидом натрия или сероводородом выпадает коричневый осадок.

На железо: а)к раствору соли железа (11) прибавляют 1 мл раствора калия феррицианида, образуется синий осадок.
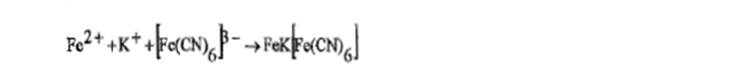
b) к раствору соли Fe3+ прибавляют раствор калия тиоционата, появляется красное окрашивание. Отбирают две порции полученногораствора. К одной порции прибавляют спирт изоамиловый, встряхивают и оставляют до расслоения; органический слойокрашивается в розовый цвет. К другой порции прибавляют раствор ртути (II) хлорида Р; красное окрашивание раствора исчезает.
с) к раствору соли железа (111) прибавляют 1 мл раствора калия феррицианида, образуется синий осадок.
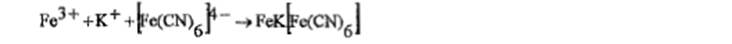
На калий:а) с раствором винной к-ты: об-ся белый кристаллич осадок
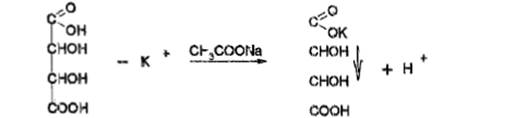
Б) с натрия кобальтинитритом, желт осадок
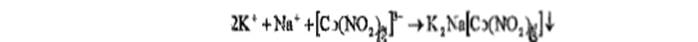

На кальций:с оксалатом аммония, белый осадок
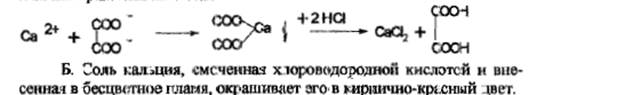
Реакции идентификации неорганических катионов: магний, натрий, ртуть, свинец, серебро, сурьма, цинк.
МАГНИЙИсп. образец растворяют в воде, + р-р аммиака разведенного  образуется белый осадок, растворяющийся при прибавлении р-ра аммония хлорида. + р-р динатрия гидрофосфата
образуется белый осадок, растворяющийся при прибавлении р-ра аммония хлорида. + р-р динатрия гидрофосфата  образуется белый кристаллический осадок. Mg2+ + HPO42- + NH3 → NH4MgPO4↓
образуется белый кристаллический осадок. Mg2+ + HPO42- + NH3 → NH4MgPO4↓
НАТРИЙ а)Исп. образец растворяют в воде, + р-р калия карбоната и нагревают до кипения; осадок не образуется. + р-р калия пироантимоната и нагревают до кипения, затем охлаждают в ледяной воде и потирают внутренние стенки пробирки стеклянной палочкой  образуется осадок белого цвета.
образуется осадок белого цвета.

b) Исп. образец растворяют воде + метоксифенилуксусной к-ты реактива, охлаждают в ледяной воде  образуется объемный белый кристалл. осадок. Смесь помещают в воду при t= 20°С и перемешивают; осадок не исчезает. + р-р аммиака разведенного; осадок полностью растворяется. + р-р аммония карбоната; осадок не образуется.
образуется объемный белый кристалл. осадок. Смесь помещают в воду при t= 20°С и перемешивают; осадок не исчезает. + р-р аммиака разведенного; осадок полностью растворяется. + р-р аммония карбоната; осадок не образуется.
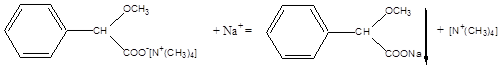
с) Соль натрия, смоченная кислотой хлористоводородной и внесенная в бесцветное пламя, окрашивает его в желтый цвет.
РТУТЬ а) Р-р исп. образца помещают на тщательно очищенную поверхность медной фольги; появляется темно-серое пятно, которое при натирании становится блестящим. Фольгу высушивают и нагревают в пробирке; пятно исчезает.b) К исп. р-ру+ р-р натрия гидроксида разведенный до сильнощелочной среды 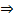 образуется плотный осадок желтого цвета: Hg22+ + 2ОН− = Hg2O ↓ + Н2O.с) К р-ру исп. образца + осторожно по каплям р-р калия йодидa
образуется плотный осадок желтого цвета: Hg22+ + 2ОН− = Hg2O ↓ + Н2O.с) К р-ру исп. образца + осторожно по каплям р-р калия йодидa 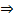 образуется красный осадок, растворимый в избытке этого реактива: Hg22++2KI = Hg2I2↓ 2K+,
образуется красный осадок, растворимый в избытке этого реактива: Hg22++2KI = Hg2I2↓ 2K+,
СВИНЕЦ а) Исп. образец растворяют в к-те уксусной + р-р калия хромата 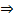 образуется желтый осадок, растворяющийся при прибавлении р-ра натрия гидроксида концентрированного: Pb2+ + CrO42-→ PbCrO4↓ b) Исп. образец растворяют в кислоте уксусной + воду и р-р калия йодида
образуется желтый осадок, растворяющийся при прибавлении р-ра натрия гидроксида концентрированного: Pb2+ + CrO42-→ PbCrO4↓ b) Исп. образец растворяют в кислоте уксусной + воду и р-р калия йодида 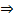 образуется желтый осадок. При кипячении осадок растворяется При охлаждении образуется осадок в виде блестящих желтых пластинок: Pb2+ + 2 I− → PbI2↓
образуется желтый осадок. При кипячении осадок растворяется При охлаждении образуется осадок в виде блестящих желтых пластинок: Pb2+ + 2 I− → PbI2↓
СЕРЕБРО а) Исп. образец растворяют в водt + HCl 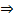 образуется белый творожистый осадок, растворяющийся при прибавлении р-ра аммиака разведенного: Ag+ + Cl− → AgCl↓b) К р-ру исп. образца + р-р аммиака разведенного до растворения образующегося вначале осадка, + р-р формальдегида и нагревают; на стенках пробирки образуется блестящий налет металлического серебра: AgCl↓ + 2NH3 → [Ag(NH3)2]+ + Cl−,
образуется белый творожистый осадок, растворяющийся при прибавлении р-ра аммиака разведенного: Ag+ + Cl− → AgCl↓b) К р-ру исп. образца + р-р аммиака разведенного до растворения образующегося вначале осадка, + р-р формальдегида и нагревают; на стенках пробирки образуется блестящий налет металлического серебра: AgCl↓ + 2NH3 → [Ag(NH3)2]+ + Cl−,
2[Ag(NH3)2]++HCHO + 2H2O → 2Ag↓ + 2NH4+ + HCOONH4 + NH3∙H2O
СУРЬМАИсп. образец растворяют при нагревании в водном р-ре калия-натрия тартрата и охлаждают. + р-р натрия сульфида 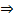 образуется оранжево-красный осадок, растворяющийся при прибавлении р-ра натрия гидроксида разведенного: 3S2− + 2 Sb3+ → Sb2S3↓
образуется оранжево-красный осадок, растворяющийся при прибавлении р-ра натрия гидроксида разведенного: 3S2− + 2 Sb3+ → Sb2S3↓
ЦИНКа) Исп. образец растворяют в воде + р-р NaOH конц. 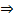 образуется белый осадок. + изб. р-ра NaOH конц. осадок растворяется. + р-р аммония хлорида; раствор остается прозрачным. К р-ру прибавляют р-р натрия сульфида
образуется белый осадок. + изб. р-ра NaOH конц. осадок растворяется. + р-р аммония хлорида; раствор остается прозрачным. К р-ру прибавляют р-р натрия сульфида 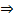 образуется белый хлопьевидный осадок: Zn2+ + Na2S→ZnS↓+ 2Na+
образуется белый хлопьевидный осадок: Zn2+ + Na2S→ZnS↓+ 2Na+
b) К исп. р-ру+ р-р калия ферроцианида 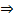 образуется белый осадок, нерастворимый в HCl разведенной: Zn2++ K4[Fe(CN)6] →ZnK2[Fe(CN)6] ↓+ 2K+.
образуется белый осадок, нерастворимый в HCl разведенной: Zn2++ K4[Fe(CN)6] →ZnK2[Fe(CN)6] ↓+ 2K+.
62. Реакции идентификации неорганических анионов: бромиды, иодиды, карбонаты и гидрокарбонаты, мышьяк (арсениты и арсенаты), нитраты.
БРОМИДЫа) Исп. образец растворяют в воде, подкисляют кислотой азотной разведенной, + р-р серебра нитрата  образуется светло-желтый творожистый осадок. К осадку + р-р аммиака; осадок медленно растворяется: Ag+ + Br− →AgBr↓ AgBr↓ + 2NH4OH →[Ag(NH3)2]Br + 2H2O
образуется светло-желтый творожистый осадок. К осадку + р-р аммиака; осадок медленно растворяется: Ag+ + Br− →AgBr↓ AgBr↓ + 2NH4OH →[Ag(NH3)2]Br + 2H2O
b) Исп. образец помещают в пробирку + воду, свинец (IV) оксид, к-ту уксусную и осторожно встряхивают. В пробирку помещают полоску фильтровальной бумаги, край кот. пропитан р-ром фуксина  появляется фиолетовое окрашивание на непропитанной части бумаги.
появляется фиолетовое окрашивание на непропитанной части бумаги.
c) К исп. р-ру + HCl разведенную, свежеприготовленный р-р хлорамина, хлороформ и взбалтывают  хлороформный слой приобретает желто-бурую окраску: хлороформный слой приобретает желто-бурую окраску:
| 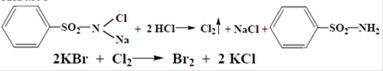
|
ЙОДИДЫ
а) Исп. образец растворяют в воде, подкисляют кислотой азотной разведенной, + р-р серебра нитрата 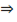 образуется светло-желтый творожистый осадок. К осадку + р-р аммиака; осадок медленно растворяется: KI + AgNO3 → AgI↓+ NaNO3
образуется светло-желтый творожистый осадок. К осадку + р-р аммиака; осадок медленно растворяется: KI + AgNO3 → AgI↓+ NaNO3
b) К р-ру исп. образца + к-ту серную разведенную, р-р калия дихромата, воду, хлороформ, встряхивают 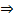 хлороформный слой приобретает фиолетовую или фиолетово-красную окраску.
хлороформный слой приобретает фиолетовую или фиолетово-красную окраску.
6I− + Cr2O72−+ 14H+ →3I2 + 4SO42− + 2Cr3+ + 7H2O; I2 → хлороформ → красно-фиолетовая окраска
с) При нагревании исп. образца с кислотой серной выделяются фиолетовые пары йода:
8I− + SO42−+ 10H+ → 4I2↑+ 4H2O + H2S↑
Дата добавления: 2016-07-09; просмотров: 5001;
