Сольватирование частиц растворенного вещества является процессом ______
1) Эндотермическим 3) Экзотермическим
2) Физическим 4) Необратимым
Растворимость газов в жидкости повышается при___
1) понижении температуры 3) повышении температуры
2) понижении давления газа 4) введении в жидкость электролитов
Зависимость растворимости газа от концентрации электролита в растворе описывается законом____
1) Генри 3) Вант-Гоффа
2) Рауля 4) Сеченова
6. Осмотическое давление раствора глюкозы с молярной концентрацией 0,1 моль/л при 25°С равно _____ кПа.
1) 61,9 2) 51,6 3) 123,8 4) 247,6
7. Осмотическое давление раствора хлорида натрия с молярной концентрацией 0,1 моль/л (изотонический коэффициент 1,95) при 25 °С равно _____ кПа.
1) 247,6 2) 482,9 3) 20,8 4) 40,5
8.Уравнение π=СRT является математическим выражением закона ___
1) Вант-Гоффа 3) Дальтона
2) Рауля 4) Сеченова
9. Осмолярная концентрация раствора глюкозы, если при температуре 25°С его осмотическое давление равно 247,6 кПа, составляет _____ моль/л.
1) 1,2 2) 0,12 3) 0,1 4) 12
Процесс перехода молекул растворителя через полупроницаемую мембрану из раствора с меньшей концентрацией в раствор с большей концентрацией называется___
1) электролитическая диссоциация 3) осмос
2) гидролиз 4) диффузия
11. Растворы хлорида натрия и глюкозы с одинаковой концентрацией имеют:
1) Одинаковое осмотической давление 3) Одинаковое давление пара над раствором
2) Разное осмотическое давление 4) Разный цвет
12. Водный раствор глюкозы с моляльной концентрацией 0,5 моль/кг замерзнет при температуре___°С. Криоскопическая постоянная воды равна 1,86.
1) – 0,93 2) 0,93 3) 0 4) – 3,72
13. Водный раствор глюкозы с моляльной концентрацией 1 моль/кг закипит при температуре ___°С. Эбулиоскопическая постоянная воды 0,516.
1) 0,516 2) 100,516 3) 273,516 4) 298,516
14. Растворы глицерина и глюкозы будут иметь одинаковое осмотическое давление при 25°С если у них ____.
1) Одинаковый объем 3) Разная концентрация
2) Одинаковая концентрация 4) Разный объем
В случае равных моляльных концентраций наибольшее понижение температуры будет в растворе
1) С6Н12О6 2) NaCl 3) KCl 4) CaCl2
Повышение температуры кипения раствора по сравнению с чистым растворителем является следствием
1) Понижения давления пара над раствором
2) Повышения давления пара над раствором
3) Повышения плотности раствора
4) Изменения поверхностного натяжения раствора
Занятие № 4
ТЕМА: Протолитические реакции. Буферные растворы.
ЦЕЛЬ:Познакомиться с основами протолитических процессов, протекающих в организме человека, усвоить природу протолитического гомеостаза и возможные причины его нарушения.
Теоретические вопросы:
1. Основные положения протолитической теории кислот и оснований. Кислоты и основания по Бренстеду-Лоури, сопряженные кислоты и основания. Константы кислотности и основности. Показатели кислотности (рКа) и основности (рКb). Связь между константой кислотности и константой основности в сопряжённой протолитической паре.
2. Диссоциация воды. Ионное произведение воды. Водородный и гидроксильный показатели, рН биологических жидкостей.
3. Изменение рН органов и тканей при различных заболеваниях. Ацидоз. Алкалоз. Способы их устранения.
4. Гидролиз солей. Степень и константа гидролиза. Амфолиты. Изоэлектрическая точка.
5. Буферные системы. Механизм буферного действия систем I и II типа. Расчет рН буферных систем при добавлении сильной кислоты или сильного основания.
6. Буферное действие. Буферная ёмкость. Расчет буферной ёмкости по кислоте и по основанию. Факторы влияющие на буферную ёмкость.
7. Буферные системы крови. Сравнительная буферная емкость буферных систем крови. Бикарбонатная, фосфатная, белковая, гемоглобиновая буферные системы. Механизм действия. Формулы для расчета.
8. Применение реакции нейтрализации в фармакотерапии.
Основные уравнения по теме:
«Протолитические реакции. Буферные растворы»
1. рKa = -lgKa - показатель константы кислотности
2. рKb =-lgKb - показатель константы основности
3. рH = -lg [H+] - водородный показатель среды
4. pOH = -lg [OH-] - гидроксильный показатель среды
5. pH + pOH = 14
6. 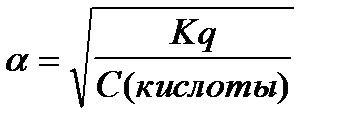 - закон разведения Оствальда
- закон разведения Оствальда
7. рH = 1/2 [pKa - lgC(1/z кислоты)] - расчет рН для растворов слабых кислот
8. pH = 14-1/2 [pKb - lgC(1/z основания)] - расчет рН для растворов слабых оснований
9. 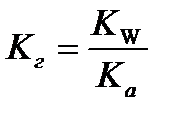 - расчёт константы гидролиза соли слабой кислоты и сильного основания
- расчёт константы гидролиза соли слабой кислоты и сильного основания
10. 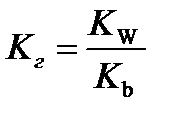 - расчёт константа гидролиза соли слабого основания и сильной кислоты
- расчёт константа гидролиза соли слабого основания и сильной кислоты
11. 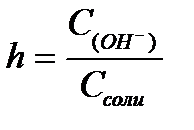 ,
, 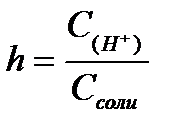 ,
, 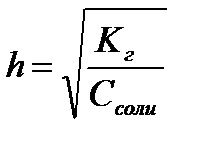 - степень гидролиза соли
- степень гидролиза соли
12. 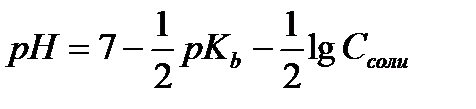 - расчёт рН раствора соли, гидролизующейся по катиону
- расчёт рН раствора соли, гидролизующейся по катиону
13. 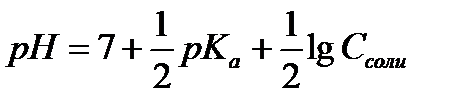 - расчёт рН раствора соли, гидролизующейся по аниону
- расчёт рН раствора соли, гидролизующейся по аниону
14. 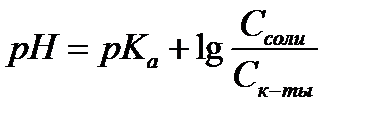 - расчет рН для буферных систем I типа
- расчет рН для буферных систем I типа
15. 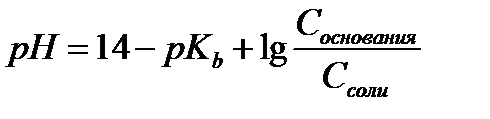 - расчет рН для буферных систем II типа
- расчет рН для буферных систем II типа
16. 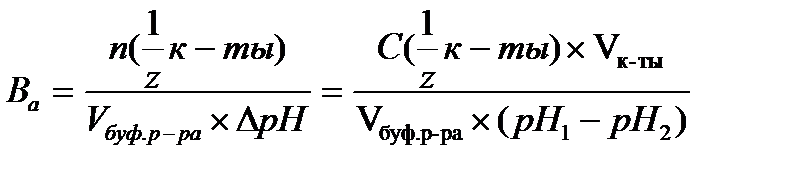 - определение буферной емкости по кислоте
- определение буферной емкости по кислоте
17. 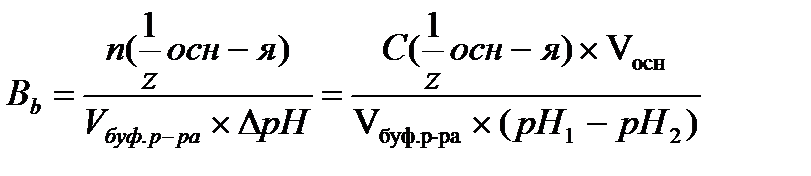 - определение буферной емкости по основанию
- определение буферной емкости по основанию
18. 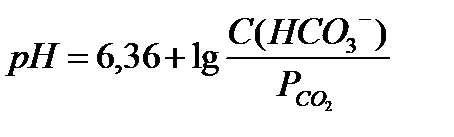 - уравнение Гендерсона-Гассельбаха для бикарбонатной буферной системы
- уравнение Гендерсона-Гассельбаха для бикарбонатной буферной системы
19. HHb + O2 + HCO3- = HbO2- + H2CO3 - суммарный процесс, протекающий в легочных капиллярах
20. HbO2- + H2CO3 = O2 + HHb + HCO3 - - суммарный процесс, протекающий в тканевых капиллярах
Обучающие задачи
Задача 1.
Биологические жидкости имеют следующие значения рН: слюна 6,8; желудочный сок 1,5; кровь 7,4. Рассчитайте концентрацию ионов водорода в каждой из указанных жидкостей.
Решение: рН= - lg [H+] , lg [H+] = - pH
а) слюна рН = 6,8 , отсюда lg [H+] = -6,8
[H+]=10-6,8=1,59∙´10 -7 моль/л
б) желудочный сок рН = 1,5
рН= - lg [H+] , lg [H+] = - pH, отсюда lg [H+] = - 1,5
[H+]=10-1,5=3,16∙´10 -2 моль/л
в) кровь рН = 7,4
рН= - lg [H+] , lg [H+] = - pH
отсюда lg [H+] = -7,4
[H+]=10-7,4 = 4,0´10 -8 моль/л
Ответ: слюна [H+] = 1,59∙´10-7моль/л, желудочный сок [H+] = 3,16´10-2 моль/л, кровь [H+] = 4´10 -8 моль/л.
Задача 2.
Вычислите степень диссоциации уксусной кислоты в растворе с молярной концентрацией эквивалента 0,001 моль/л. Ка (СН3СООН) = 1,8´10-5. Найти концентрацию ионов водорода и рН данного раствора.
Решение:
рН = 1/2 [pKa - lgC(CH3COOH)]; pH = 1/2 [4,75 - lg 0,001] = 1/2∙´ 7,75 = 3,875
[H+] = 10-pH = 10-3,875 = 1,35 ×10 -4;
[H+] = 1,35´10-4 моль/л.
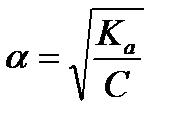 или
или
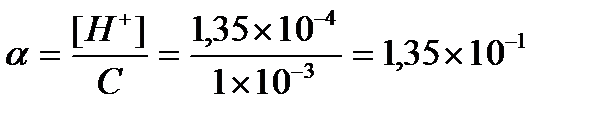 или 13,5%
или 13,5%
Ответ: [H+] = 1,35 ´10-4 моль/л, рН = 3,875, α = 13,5%.
Задача 3
В клинических и биохимических лабораториях применяется ацетатный буфер, который содержит уксусную кислоту 12 г/л и ацетат натрия 16,4 г/л. Определите концентрацию в моль/л уксусной кислоты и ацетата натрия, рН буферного раствора, зону буферного действия. (Ка (СН3СООН) = 1,8 ´10-5).
Решение:
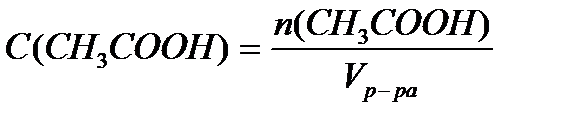
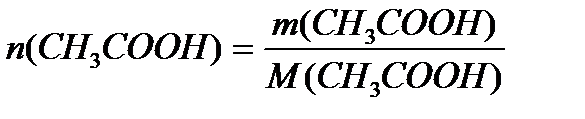
M (CH3COOH) = 12+3+12+32+1 = 60 г/моль
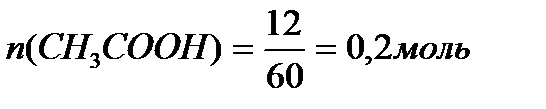
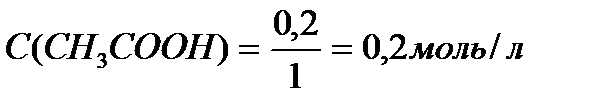
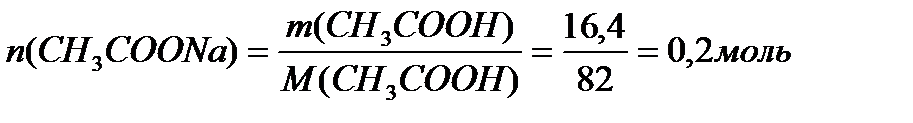
M (CH3COONa) = 12+3+12+32+23 = 82 г/моль.
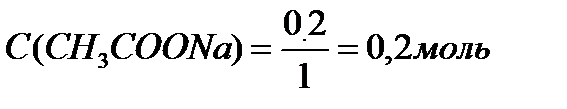
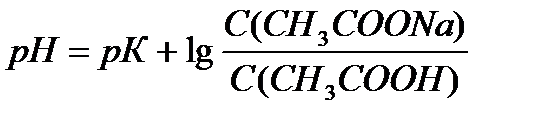
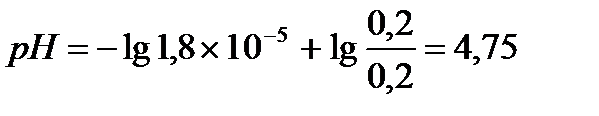
Ответ: С(CH3COOH)=0,2 моль/л, С(CH3COONa) =0,2 моль/л, pH = 4,75, зона буферного действия 4,75 ±1
Задача 4.
Для гидролизующихся веществ напишите уравнения гидролиза: CuCl2, Na2SO3, Cr2S3, NaCl, тристеарид, глицил-глицин, этилэтаноат, АТФ.
Решение:
CuCl2 – растворимая в воде соль, образована катионом слабого основания и анионом сильной кислоты, подвергается гидролизу. Гидролиз протекает по катиону слабого основания, рН<7.
При обычных условиях гидролиз протекает преимущественно по I ступени.
CuCl2 = Cu2+ + 2Cl-
Cu2+ +HOH ↔ CuOH+ + H+
CuCl2 + HOH ↔ CuOHCl + HCl
Na2SO3 – растворимая в воде соль, образована катионом сильного основания и анионом слабой кислоты, подвергается гидролизу. Гидролиз протекает по аниону слабой кислоты, рН>7.
Na2SO3 = 2Na+ + SO32-
SO32- + HOH ↔ HSO3- + OH-
Na2SO3 + HOH ↔ NaHSO3 + NaOH
Cr2S3– соль, образованная слабым нерастворимым в воде основанием и слабой летучей кислотой. В водном растворе соль не существует, так как подвергается полному гидролизу:
Cr2S3 + 6HOH = 2Cr(OH)3↓ + 3H2S↑
NaCl– растворимая в воде соль, образована катионом сильного основания и анионом сильной кислоты. Гидролизу не подвергается.
Тристеарид – это жир, образованный многоатомным спиртом глицерином и стеариновой кислотой, эти вещества и получаются при гидролизе:
CH2-O-CO-C17H35 CH2-OH
| |
CH-O-CO-C17H35 + 3H2O ↔ CH-OH + 3C17H35COOH
| |
CH2-O-CO-C17H35 CH2-OH
Глицилглицин– дипептид, при его гидролизе происходит разрыв пептидной связи
NH2-CH2-CO-NH-CH2-COOH +H2O ↔ NH2-CH2-COOH + NH2-CH2-COOH
Этилэтаноат – сложный эфир, при гидролизе которого образуются спирт и карбоновая кислота.
СH3COOC2H5 + HOH ↔ CH3COOH + C2H5OH
Аденозинтрифосфат (АТФ) – главный источник энергии для многих биологических процессов – биосинтеза белка, ионного транспорта, сокращения мышц, электрической активности нервных клеток. Гидролиз АТФ записывают в виде кислотно-основного равновесия:
АТФ4- + HOH ↔ АДФ3- + HPO42- + H+, ∆G0=-30,5кДж/моль
Задача 5.
Определить рН раствора, константу и степень гидролиза ацетата калия, если молярная концентрация соли равна 0,1 моль/л, а Kа(СН3СООН)=1,8×10-5.
Решение:Уравнение гидролиза
СН3СООК + НОН ↔ СН3СООН + КОН
СН3СОО- + НОН ↔ СН3СООН + ОН-
Вычислим константу гидролиза
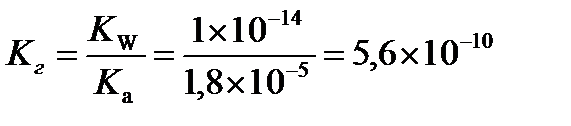
Рассчитаем степень гидролиза
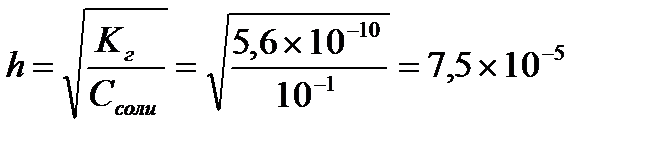
Определяем концентрацию гидроксид-ионов в растворе и рОН
С(ОН-)= h×Cсоли = 7,5×10-5×0,1 = 7,5×10-6 (моль/л)
рOН = -lg[OH-] = -lg7,5×10-6 = 5,12
pH = 14 – pOH = 14 – 5,12 = 8,88
Ответ:рН = 8,88, Кг = 5,6×10-10, h = 7,5×10-5
Задачи для самостоятельного решения:
Задача 1. Вычислите степень диссоциации и рН уксусной кислоты, если Ка (СН3СООН) = 1,8´10 -5, а концентрация 0,18 моль/л.
Ответ: рН = 2,74; α= 1 %.
Задача 2. Концентрация ионов [OH-] в растворе равна 6,5×10-8 моль/л. Вычислите рН этого раствора.
Ответ: рН=6,81
Задача 3. Во сколько раз концентрация ионов водорода в крови (рН=7,36) больше, чем в спинномозговой жидкости (рН=7,53)?
Ответ: в 1,5 раза
Задача 4. Определите концентрацию ионов водорода желчи в протоках, если её рН= 7,8 - 8,5.
Ответ:1,58´10-8 - 3,16´10-9
Задача 5.Вычислите соотношение с (соли) /с (кислоты) для буферной системы муравьиная кислота - формиат натрия, если рН = 4,0, Ка (НСООН) = 1,76´10 -4.
Ответ: 1,76
Задача 6.Определите рН буферного раствора, который получен смешиванием 0,1 моль/л раствора NH4Cl и 0,1 моль/л раствора NH4OH в соотношении: а) = 1:1, б) 1:4, в) 4:1. К (NH4OH) = 1,79´10 - 5
Ответ: а) рН = 9,26 , б) рН = 9,86, в) рН= 8,66.
Задача 7. Вычислите массу ацетата натрия, которою следует добавить к раствору уксусной кислоты С(СН3СООН) = 0,316 моль/л и объемом 2 л, чтобы получить буферный раствор с рН = 4,87.
Ответ: 68,4 г
Задача 8. Сколько молей эквивалента аскорбиновой кислоты необходимо ввести больному для нормализации крови при алкалозе, если рН его крови 7,65 (норма 7,45) общее количество крови 5л, буферная емкость по кислоте 0,05 моль/л.
Ответ: 0,05 моль - эквивалента.
Задача 9.? Буферная емкость по кислоте 0,05 моль/л, рассчитайте, какой объем хлороводородной кислоты концентрацией 0,1 моль/л необходимо добавить к 1л крови, чтобы уменьшить её рН с 7,35 до 7,1?
Ответ: 0,125 литра
Задача 10.Напишите по стадиям уравнения реакций гидролиза следующих солей: FeCl3, CuSO4. На основании чего можно утверждать, что последняя стадия реакции гидролиза этих солей не происходит.
Тестовые вопросы
1. Сокращенное молекулярно-ионное уравнение Ва+2+SO42-=BaSO4 соответствует реакции…
1) Ba(NO3)2+SO2® 2) BaCO3+H2SO4®
3) BaCl2+Na2SO4® 4) Ba3(PO4)2+H2SO4®
2. Полному гидролизу подвергаются соли…
1) CrCl3 3) Cr2S3
2) Al2(SO4)3 4) Cs2CO3
3. Нейтральную среду имеют растворы солей …
1) RbNO3 2) HCOOK 3) BaCl2 4) CsF
4. Кислую среду имеют растворы солей…
1) K2SiO3 2) AlCl3 3) (NH4)2SO4 4) CaCl2
5. Сильными электролитами являются …
1) HI 2) CuSO4 3) NH4OH 4) Ca3(PO4)2
Дата добавления: 2016-06-24; просмотров: 2261;
