В (4) учтено, что согласно теореме о среднем структура формулы для вы-числения среднего значения величины зависит от структуры формулы, в которую входит осредняемая величина.
Влияние внешних факторов на скорость коррозии.
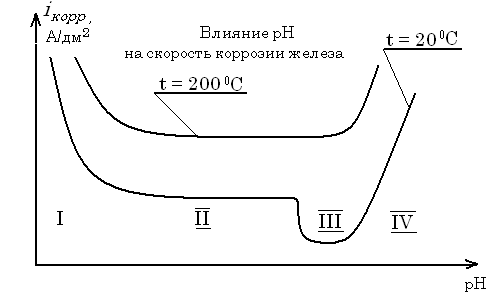
Влияние рН
На железо
9.1.1. Влияние рН на Ni, Co, Cd (не стойки в кислых средах)
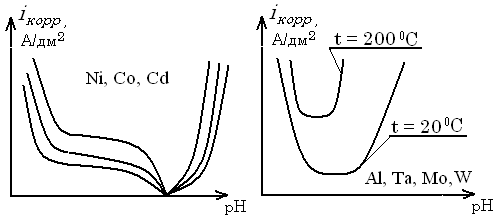
9.1.2. Та, Мо, W - не стойки как в кислых средах, так и в щелочных
(амфотерность Al)
9.2. Влияние окислителей
Окислители условно можно разделить на две группы:
1) окислители, которые увеличивают скорость катодного процесса и не влияют на скорость анодного процесса:
2) окислители, которые увеличивают скорость катодного процесса и тормозят протекание анодного процесса растворения металла.
К первой группе можно отнести, например, ионы трехвалентного железа и двухвалентной меди. Их присутствие в воде увеличивает скорость катодного процесса, а соответственно, потенциал металла.
В соответсвии с этим, если в воде растворен кислород, то увеличение его концентрации приводит к возрастанию скорости коррозии (в области потенциалов активного растворения).
Если стационарный потенциал металла находится в области анодно- пассивного состояния, то при изменении концентрации окислителей, скорость коррозии не изменяется. При очень высоких концентрациях металл переходит из области потенциалов пассивного состояния в область перепассивации, а это приводит к увеличению скорости коррозииметалла.
Таким образом могут быть реализованы различные, противоположного направления последствия наличия окислителей первой группы.
Ко второй можно отнести перманганаты,, нитриты, хроматы. Взаимодействие их с поверхностью металла создает предпосылки к торможению анодного процесса посредством анодной пассивации. Эти окислители
9.2. Влияние замедлителей (Ингибиторы)
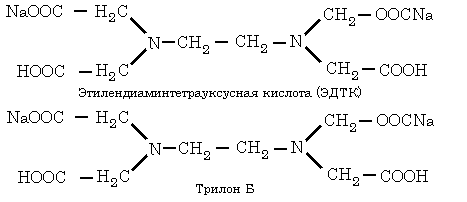
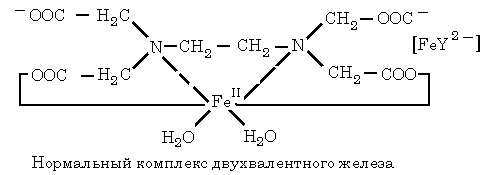
Комплексоны
9.3. Влияние температуры
Расчет определяющей температуры процесса коррозии при наличии оксидной пленки, отложений и теплового потока на теплообменных трубках ПГ.
Формула для расчета перепада темпера-
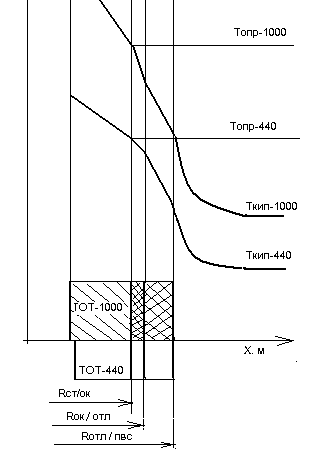 туры в тепловом пограничном слое
туры в тепловом пограничном слое
 DТтпс = qs /a (1)
DТтпс = qs /a (1)
Формула для расчета перепада темпера
туры в слое отложений:
DТотл = qs dотл / lотл (2)
Формула для расчета перепада тем-пера туры в оксидном слое:
DТок= qs dок / lок (3)
Формула для расчета перепада темпера
туры в стенке теплообменной трубки (ТОТ):
DТст = qs dст / lст (4)
Таким образом, температуру, определя- ющую скорость процесса взаимодейст-
вия металла ТОТ с раствором элек-тро лита, можно олределить экспериментально-аналитическим методом по формуле
Топр= Тпвс+ DТтпс +DТотл (5)
Рис 9.1
Границы раздела: Rст/ок, Rок/отл, Rотл/пвс, - Схема расчета определяющей темпера-
оксида и отложений; отложений и паро- туры, находящаяся для сталей на грани-
водяной смеси. це раздела оксид/металл, дана на рис. 9.1.
Температуры границ Если раскрыть символы в правой части,
разделов:Топр-1000, Топр-440, соответ- (5), то получим выражение для Топр:
ственно, определяющие скорости корро- определяющей скорость коррозии стали
зии для ПГВ-1000 и ПГВ 440 марки 08З18Н10Т
Топр= Тпвс+(qs /a )+(qs dотл / lотл ) (6)
Если этот же подход использовать для цветных металлов (например, цирконий), то
Топр= Тпвс+ DТтпс +DТок+ DТотл = Тпвс+ (qs /a )+(qsdотл /lотл) +(qsdок /lок )
(7)
Для скорости коррозии стали на внутренней поверхности стенки ТОТ температуру, определяющую скорость процесса взаимодействия металла ТОТ с раствором электролита, находящаяся для сталей на границе раздела оксид металла стенки ТОТ и отложения на внутренней поверхности, можно определить по формуле (8)
Топр= Тпвс+ DТтпс + (DТок)н + (DТотл) н +DТст+ (DТок)вн = = Тпвс+ (qs /a )+
+ (qsdок /lок )н + (qsdотл /lотл)н+ (qs dст /lст) +(qs dок /lок)вн (8)
Таким образом, если среда - греющая, то температура, определяющая скорость процесса коррозии – ниже температуры среды. В случае обогреваемой среды - температура, определяющая скорость процесса коррозии – выше температуры среды.
9.4. Влияние движения среды (ЭКИ)
9.5. контактная коррозия
9.6. Щелевая коррозия
9.7. подшламовая коррозия
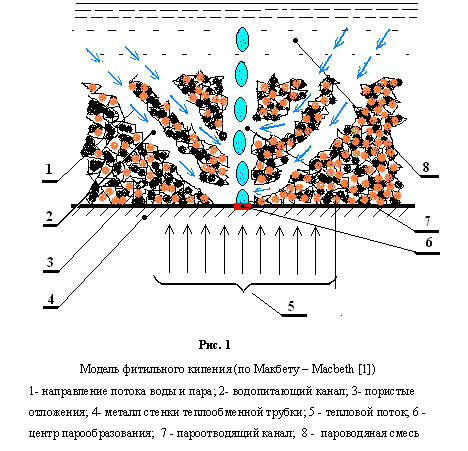
На рис. 1 представлена иллюстрация модели «фитильного кипения» cог-ласно [1]. Частицы, формирующие пористые отложения, представляют собой объемы тетраэдрической формы (шпинели) оксидов железа [2]. Размер ребер тетраэдров зависит от водородного показателя рН водной среды, в которой они формируются: при рН=10 ребро а=0,1 мкм, а при рН=2 ребро а уже равно 10,0 мкм. Пористость e объемов, заполненной свободной засыпкой тел неправильной формы лежит в пределах: 0,4 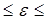 0,6. Для расчетов обычно принимают e =0,5 [3].
0,6. Для расчетов обычно принимают e =0,5 [3].
Известна изотерма адсорбции, полученная экспериментально [4]
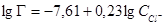 (1)
(1)
где: Г – адсорбция хлорид-иона, г-экв/см2; 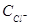 – концентрация хлорид-иона в
– концентрация хлорид-иона в
водной среде отложений, г-экв/л.
Так как в природе нет чистого железа, поверхность которого не покрыта оксидом, то можно предположить, что (1) справедлива именно для случая адсорбции хлорид-иона на оксиде железа. Если это предположение справед-ливо, то в случае адсорбции хлорид-иона на развитой поверхности пористых отложений (1) преобразуется к виду (2)
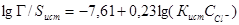 (2)
(2)
где: Sист – истинная поверхность всех кристаллов отложений феррооксидов на единице площади видимой поверхности ТОТ; Кист – истинный коэффициент концентрирования хлорид-иона.
Величина Г определяется по содержанию хлорид-иона в навеске пробы отложений, снятой с определенной поверхности ТОТ. Нерастворимых и недиссоциированных хлорид-содержащих соединений в отложениях нет. Поэтому можно утверждать, что хлорид-ионы равномерно распределены по поверхности кристаллов отложений. В этом случае отношение (Г/Sист) следует интерпретировать как истинную изотерму адсорбции хлорид-ионов на поверхности кристаллов отложений.
Числовое значениеКист в таком случае определится из (2)
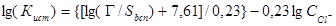 (3)
(3)
Таким образом, задача в упрощенном виде сводится к определению истин-ной поверхности навески отложений на 1 см2 видимой обогреваемой тепло-обменной трубке парогенератора.
Для этого надо задать некоторые числовые значения для плотности отло-жений Н (Г/м2) и их пористости. В [2] для рыхлых отложений предлагается принимать Н=0,7 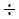 2,0 Г/см3; а для плотных Н= 4,0
2,0 Г/см3; а для плотных Н= 4,0 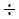 4,4.
4,4.
В табл. 1 приведены удельная загрязненность g и концентрация хлорид-иона С 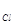 в навесках проб отложений, взятых в разных местах трубного пучка парогенератора на одном из энергоблоков АЭС с ВВЭР-440. В табл. 1 также представлены сведения о среднеинтегральной концентрации хлорид-иона в воде продувки за весь межпромывочный период (8 лет). Энергоблок эксплу-атировался при допустимой концентрации хлорид-иона в воде продувки не более 500 мкг/кГ (согласно действовавшим в тот период Нормам ВХР).
в навесках проб отложений, взятых в разных местах трубного пучка парогенератора на одном из энергоблоков АЭС с ВВЭР-440. В табл. 1 также представлены сведения о среднеинтегральной концентрации хлорид-иона в воде продувки за весь межпромывочный период (8 лет). Энергоблок эксплу-атировался при допустимой концентрации хлорид-иона в воде продувки не более 500 мкг/кГ (согласно действовавшим в тот период Нормам ВХР).
Среднеинтегральная концентрация хлорид-иона в воде продувки за весь межпромывочный период вычислялась по формуле [5]

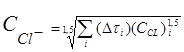 (4)
(4)
В (4) учтено, что согласно теореме о среднем структура формулы для вы-числения среднего значения величины зависит от структуры формулы, в которую входит осредняемая величина.
Результаты обработки данных табл.1 с помощью формулы (2) приведены в табл.2.
Таблица 1
Удельная содержание хлорид-иона в навесках отложений

Место отбора Среднеинтегральная

 Парогенератор Холодный Люк-лаз концентрация
Парогенератор Холодный Люк-лаз концентрация
коллектор хлорид-ионов



 g М
g М 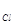 g М
g М 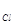 С
С 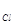
Г/м2 мГ/см2 10-3 Г/м2 мГ/см210-3 мкГ/кГ.

ПГ-1 69,3 4,2 )* )* 325,0
ПГ-2 56,2 32 63,8 5,9 282,0
ПГ-3 )* )* 64 2,1 299,0
ПГ-4 114,0 9,6 99,5 21,0 425,0
ПГ-5 97,4 6,7 128,0 8,8 345,0
 ПГ-6 81,9 8,6 89,5 6,2 412,0
ПГ-6 81,9 8,6 89,5 6,2 412,0
 )* - навеска не отбиралась
)* - навеска не отбиралась
Таблица 2
Коэффициент концентрирования хлорид-иона при кипении воды в пористых отложениях на теплообменных трубках паргенераторов



 а, мкм пористость
а, мкм пористость 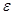 , %
, %
 |
40 45 50 55 60
 Навески, взятые у холодного коллектора ПГ-1
Навески, взятые у холодного коллектора ПГ-1

2,5 24,6 14,7 9,3 6,1 )**
3,0 )** 32,5 20,6 13,6 9,3
3,5 )** )** )** 26,6 18
 4,0 )** )** )** )** 32,5
4,0 )** )** )** )** 32,5







 Навески, взятые у люка-лаза ПГ-2
Навески, взятые у люка-лаза ПГ-2
1,5 10,3 11,6 7,3 )** )**
2,0 )** 40,4 25,3 16,9 11,6
2,5 )** )** )** 44,5 30,5

 )** - расчет не проводился
)** - расчет не проводился
Анализ результатов обработки данных табл.1 следует, что максимальное и числовое значение коэффициента концентрирования хлорид-иона в воде при кипении в пористых отложениях на теплообменных трубках равно 40,4, а минимальное 6,1. Эти числа сильно отличаются от таковых, но полученных по методикам других авторов [4, 6], соответственно равных 200 и 200000. В то же время числовые значения этих коэффициентов позволяют лишь частично объяснить эффект «хайд-аут», но весьма уязвимы для критики в следующем аспекте.
Если умножить среднюю концентрацию хлорид-иона воды продувки (данные табл. 1) на 200 (не говоря уже 200 000), то получим минимум 56400 мкГ/кг и максимум 85000 мкГ/кГ. Известно, что в стенках теплообменных трубок Первой в мире АЭС сквозные коррозионные трещины появились после 20 000 часов эксплуатации, а концентрация хлорид ионов в воде про-дувки лимитировалась 75,0 мГ/кГ и их пришлось заменить.
Парогенераторы же анализируемого энергоблока работают без замены уже более 30 лет. На теплообменных трубках парогенераторов комбината АЭС «Бруно Лейшнер» после попадания морской воды вместе с питательной водой (хлорид-ионов в воде продувки 80  130 мкГ/кг, продолжительность эксплуатации в этих условиях две недели) уже через 1 год после инцидента были отмечены массовые коррозионные трещины. Лабораторные эксперименты также показывают, что при контакте аустенитной хромоникелевой стали марки 08Х18Н10Т, свободной от отложений и без парообразования на стенке трубчатого образца, но в кипящем 42-х % растворе MgCl2 коррозионные трещины появляются примерно через 2
130 мкГ/кг, продолжительность эксплуатации в этих условиях две недели) уже через 1 год после инцидента были отмечены массовые коррозионные трещины. Лабораторные эксперименты также показывают, что при контакте аустенитной хромоникелевой стали марки 08Х18Н10Т, свободной от отложений и без парообразования на стенке трубчатого образца, но в кипящем 42-х % растворе MgCl2 коррозионные трещины появляются примерно через 2  3 месяца выдержки.
3 месяца выдержки.
Если принять удельную загрязненность теплообменной поверхности паро-генератора типа ПГВ-1000 всего 100 Г/м2, то полная масса отложений на трубках составит примерно 600 кГ, а занимаемый ими объем 160 литров. При пористости 50% объем воды в порах составит 80 литров, т.е. всего 0,001 от объема воды второго контура в одном парогенераторе. Нетрудно вычислить, что только лишь за счет эффекта «хайд-аут» изменению концентрации в воде второго контура только в 2 раза должно соответствовать изменение конце-траци в кипящей воде в порах отложений не менее, чем в 2000 раз! Ресурс теплообменной трубки из аустенитной хромоникелевой стали марки 08Х18Н10Т не составит и года в этих условиях. Этого не наблюдается на практике эксплуатации энергоблоков АЭС с ВВЭР.
Кроме того, при переходе с одного уровня мощности на другой числовое значение водородного показателя рН воды продувки второго контура уменьшается на несколько единиц. А это явление пока не нашло своего объяснения.
Эти и подобные размышления позволяют утверждать, что только одним «прятанием» примесей в кипящем растворе в пористых отложениях эффект «хайд-аут» объяснить нельзя.
Есть еще одна гипотеза, а именно.
Эффект «хайд-аут» проявляется только при переходе с одного уровня мощности на другой. Это означает, что при изменении мощности следует изменить расход питательной воды, поступающей в парогенератор. За этим изменением следует изменение векторов и абсолютных значений скоростей потоков воды второго контура в локальных объемах водяной части парогенератора. Следовательно, локальные зоны с относительно малыми скоростями потоков котловой воды меняют свои координаты. Т.е., там, где в стационарном режиме эксплуатации была зона с малыми скоростями (и это способствовало накоплению осадочных отложений), там формируется зона с повышенными скоростями. Такие потоки переводят часть осадочных отложений (шлама) во взвешенное состояние именно после изменения расхода питательной воды и изменения паропроизводительности парогенератора.
Адсорбированные и накопленные ранее в стационарном режиме работы на частичках феррооксидов хлорид-ионы частично десорбируются, увеличивая концентрацию в воде продувки. Десорбция происходит в соответствии с (1). Накопление хлорид-ионов в виде адсорбированных поверхностью частиц феррооксидов может протекать, например, по следующим причинам.
Во влажных осадочных отложениях (шламе) протекает преобразование двухвалентного гидрооксида железа в трехвалентную форму
H2O 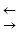 H+ + OH– (5)
H+ + OH– (5)
_
Fe(OH)2 + OH– + H+ 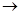 Fe(OH)3 + e + H+ (6)
Fe(OH)3 + e + H+ (6)
Таким образом идет накопление ионов водорода и величина водородного показателя рН в воде, находящейся в объеме пор, понижается на несколько порядков. В частности, во Львовском институте механики (Украина) в начале 90-х годов экспериментально получено, что рН на дне капилляра глубиной 5 мм и диаметром 0,2 мм снижается от 7 (на входе) до 2. Т.е., концентрация ионов водорода на несколько порядков увеличивается, поскольку массообмен между внешним объемом воды с нормальным водородным показателем рН и практически замкнутым объемом поры в шламе не идет.
Однако ни электрон, ни протон в водной среде самостоятельно существовать не могут. Поэтому протон образует с молекулой воды гидроксоний H3O+, а электрон нейтрализуется каким-либо положительно заряженными ионом, например ионом натрия. Или переходит в состав электронного газа электропроводящих отложений. Гидроксоний за счет электростатических кулоновских сил втягивает в объем пор осадочных отложений (шлама) отрицательно заряженные ионы, в том числе и ион хлора. Поскольку ион хлора не образует нерастворимых в воде соединений (кроме ионом серебра) и находится в полностью диссоциированном виде, то он адсорбируется на внутренней поверхности пор, образованных осадочными отложениями. Гидроксоний же продолжает втягивать отрицательно заряженные ионы. Чем ниже числовое значение рН в воде, содержащейся в порах отложений, тем интенсивнее идет процесс накопления осадочными отложениями хлорид-ионов и гидроксония. Т.е, чем интенсивнее идут реакции (5) и (6), тем больше концентрация хлорид-ионов, и тем больше хлорид-ионов адсорбируются внутренней поверхностью пор железооксидных отложений.
Электроны понижают потенциал электропроводных отложений локаль-но, что может интенсифицировать процесс втягивания ионов натрия Na+. Известно, например, что в воде второго контура концентрация ионов натрия и ионов хлора относятся как 2:1.
Вместе с тем, чем ниже рН, тем больше размер ребра кристалла ферро-шпинели [2]. Кроме того, некоторые втягиваемые электростатическим полем гидроквония отрицательно заряженные ионы могут образовывать с гидратом окиси железа слабые электролиты и слабо растворимые соединения. Наличие таких соединений и рост размера ребра ограничивает сорбирующую способ-ность осадочных отложений и увеличивает их коагуляцию.
Косвенным свидетельством в пользу высказанной гипотезы может слу-жить тот факт, что при проявлении эффекта «хайд аут» наблюдается и сни-жение рН на 2  3 единицы, и даже больше.
3 единицы, и даже больше.
Относительно просто оценить, что при наблюдении эффекта «хайд аут» со снижением в воде продувки рН на 2 единицы, концентрация хлорид иона может вырасти на порядок.
В данной работе использованы сведения, содержащиеся в [7].
Если приведенные рассуждения имеют место быть, то их следствием должны стать следующие технологические действия по предотвращению за-крепления взвешенных частиц шлама на трубках парогенераторов, а именно:
– в переходном режиме и во время останова энергоблока продувку парогенераторов увеличивать до максимума возможного;
– во время химической отмывки парогенераторов применять устройство для перемешивания растворов моющих композиций и также дренировать раствор взвешенных частиц шлама с максимально возможным расходом [8];
| <== предыдущая лекция | | | следующая лекция ==> |
| Рост питтингов после химической отмывки отложений меди | | | Состояние поверхности. |
Дата добавления: 2016-06-02; просмотров: 1426;
