Адсорбция радионуклидов
Как указывалось выше, адсорбционное соосаждение заключается в переносе вещества из раствора на поверхность твердой фазы, носящей название адсорбента. Адсорбция может происходить на твердой фазе с сильно развитой поверхностью: на мелкокристаллических осадках, коллоидах и т. д. Адсорбция играет огромную роль в гипергенной и техногенной геохимии радионуклидов.
В случае адсорбции на полярных кристаллах адсорбционные явления классифицируют по местонахождению сорбированных ионов. Если последние находятся в поверхностном слое кристаллической решетки — во внутренней обкладке двойного электрического слоя, то такая адсорбция называется первичной. Если адсорбционный ион входит в состав внешней обкладки двойного слоя — находится в растворе у границы раздела фаз, такая адсорбция называется вторичной. Первичную адсорбцию подразделяют на потенциалобразующую и обменную. Потенциалообразующая адсорбция имеет место для весовых концентраций ионов. Первичная обменная адсорбция происходит благодаря кинетическому обмену между ионами поверхности кристалла и раствора.
Вторичная адсорбция также делится на два вида: обменную и ван-дер-ваальсову. Для микроконцентраций радионуклилов имеют значение лишь первичная и вторичная обменные адсорбции.
Адсорбция на ионных кристаллах происходит в соответствии с законом Гана: «Радионуклид адсорбируется на полярном кристалле в том случае, если поверхность кристалла имеет заряд, противоположный заряду иона радионуклида. При этом адсорбция тем сильнее, чем менее растворимо и диссоциировано соединение радионуклида с противоположно заряженным ионом решетки».
Из определения ясно, что первичная адсорбция ионов возможна, если они способны входить в данную кристаллическую решетку (образовывать твердые растворы с осадком, давать смешанные кристаллы и т. д.). Таким образом, первичная адсорбция может быть выражена как распределение вещества между раствором и поверхностью осадка:
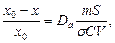
где х – количество грамм-ионов микрокомпонента на поверхности осадка; х0 — его количество в системе; х0 - х – количество грамм-ионов микрокомпонента в растворе; D – коэффициент распределения; т – масса осадка; S – удельная поверхность осадка; σ – поверхность, занимаемая 1 г-ионом стабильного элемента; V – объем раствора; С – молярная концентрация макрокомпонента (обмениваемого иона) в растворе.
Если первичная обменная адсорбция происходит лишь на поверхности решетки, то при гомогенном распределении микрокомпонента кинетика адсорбции должна отвечать закону мономолекулярной реакции:
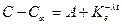 ,
,
где С и Сх – концентрации микрокомпонента в растворе в момент времени t и при достижении равновесия соответственно; А, К и λ. – константы.
Чаще обменная адсорбция является более сложным процессом. Обменная адсорбция протекает быстро на поверхности твердой фазы. За ней следует вторая стадия – медленный переход сорбированного микрокомпонента внутрь твердой фазы – внутренняя адсорбция. В этом случае кинетика адсорбции выражается равенством
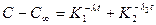 .
.
Вторичная обменная адсорбция, которая происходит во внешней части двойного электрического слоя, экспоненциально зависит от заряда иона. Действительно, эксперименты показали, что при прочих равных условиях адсорбция на отрицательно заряженных кристаллах AgI зависит от заряда иона: Ra2+ : Ас3+ : Th4+ = 7,0 : 75,2 : 100. Адсорбция происходила во внешнем слое, так как катионы не изоморфны с AgI.
Дата добавления: 2016-06-02; просмотров: 1601;
