Обучающие задачи и эталоны их решения. Задача №1. Как изменяются кислотные свойства в ряду соединений: метиловый спирт - глицерин - фенол - уксусная кислота - щавелевая кислота?
Задача №1. Как изменяются кислотные свойства в ряду соединений: метиловый спирт - глицерин - фенол - уксусная кислота - щавелевая кислота?
Эталон решения. Как известно, кислоты − это доноры протонов, которыми могут быть органические соединения: 1) содержащие атомы водорода, соединенные с электроотрицательным атомом (кислород, сера и т.д.), 2) имеющие атомы водорода у углеродного атома, соединенного с электроноакцепторными заместителями.
Из первой группы веществ рассмотрим свойства спиртов, фенолов и карбоновых кислот. Полярность О-Н связи в гидроксильной группе спирта обусловливает ее способность к гетеролитическому разрыву при взаимодействии с активными металлами. При этом получаются твердые растворимые в спирте соединения − алкоголяты с ионной связью кислород - металл:
2CH3OH+2Na→2CH3ONa+H2
Положительный индуктивный эффект углеводородного радикала уменьшает полярность О-Н связи и ослабляет кислотные свойства спиртов:
CH3→O←H
Поэтому спирты являются более слабыми кислотами, чем вода (рКа воды равна 15,7, метанола − 16, этанола − 18). По этой же причине кислотность спиртов уменьшается с увеличением числа углеродных атомов в радикале.
Кислотность многоатомных спиртов выше, чем одноатомных, благодаря -І-эффекту гидроксильных групп (рКа этиленгликоля равна 15,18). Особенно легко атомы водорода многоатомных спиртов замещаются некоторыми тяжелыми металлами вследствие образования хелатных (внутрикомплексных) соединений:
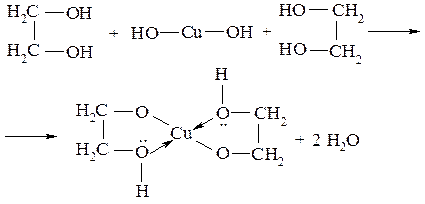
Хелаты имеют яркую окраску и используются для качественного определения многоатомных спиртов. Кислотность фенолов выражена сильнее, чем у спиртов (рКа фенола равна 10,0, т.е. на 6 единиц меньше, чем рКа алифатических спиртов). Это объясняется тем, что спаренные электроны атома кислорода смещены к ароматическому ядру (+М-эффект), что ведет к увеличению поляризации О-Н связи
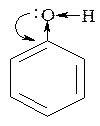
В отличие от алифатических спиртов фенол легко взаимодействует со щелочами, образуя соли − феноляты:
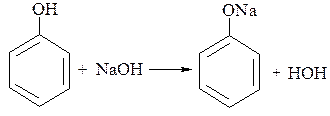
Фенолы реагируют также с металлами, солями, проявляя химические свойства кислот.
Наиболее ярко кислотные свойства выражены в ряду карбоновых кислот − соединений, содержащих карбоксильные группы. Наличие по соседству с гидроксилом карбонильной группы обусловливает сопряжение спаренных электронов кислорода гидроксильной группы с электронами π-связи карбонила:
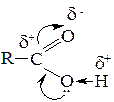
В результате электронодефицитность атома кислорода возрастает, что ведет к усилению поляризации О-Н связи и облегчает возможность отщепления протона. В водном растворе низшие карбоновые кислоты заметно диссоциируют с образованием протонов:
CH3COOH↔ CH3COO−+H+
Карбоксилат-анион представляет собой делокализованную трехцентовую систему, в которой связи атома углерода с обоими атомами кислорода выровнены:
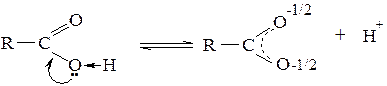
Карбоновые кислоты − слабые электролиты. Чем более стабилен образующийся при диссоциации анион, тем сильнее равновесие процесса диссоциации смещено вправо. Следовательно, чем стабильнее анион, тем сильнее кислота. Стабильность аниона в свою очередь определяется степенью делокализации отрицательного заряда. Поэтому факторы, способствующие делокализации, усиливают кислотность, а факторы, препятствующие делокализации, понижают ее. Это в равной степени характерно и для других классов соединений, проявляющих кислотные свойства. В частности, дикарбоновые кислоты являются более сильными кислотами, чем одноосновные с тем же числом атомов углерода, вследствие -I-эффекта второй карбоксильной группы:
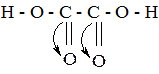
Карбоновые кислоты изменяют окраску индикаторов и проявляют все свойства кислот, взаимодействуя с металлами, основаниями, основными оксидами, солями. Проиллюстрируем это на примере двухосновных кислот, играющих важную роль в биохимических превращениях. Как и все двухосновные кислоты, они могут образовывать средние и кислые соли:
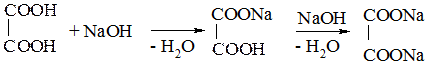
щавелевая кислота гидрооксалат натрия оксалат натрия
Таким образом, в ряду метиловый спирт − глицерин − фенол − уксусная кислота − щавелевая кислота кислотность возрастает.
Задача №2. Какие вещества образуются из уксусного и бензойного альдегида в щелочной среде?
Эталон решения. Органические соединения, имеющие атомы водорода в α-положении по отношению к электроноакцепторным заместителям (карбонил, нитрогруппа и др.) могут в соответствующих условиях отщеплять протон, проявляя кислотные свойства. Это явление называется СН-кислотностью, а вещества – СН-кислотами. Примером проявления СН-кислотности является альдольная конденсация - взаимодействие молекул альдегидов между собой в присутствии водного раствора щелочи.
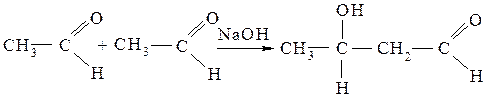
альдоль
Гидроксильный ион щелочи, отрывая протон от α-углеродного атома, превращает молекулу в карбанион:

карбанион
Этот анион обладает определенной стабильностью, так как при отделении протона α-атом углерода переходит в состояние sp2-гибридизации, у него появляется негибридная p-орбиталь, которая вступает в сопряжение с π-связью карбонильной группы. Далее карбанион присоединяется к карбонильной группе другой молекулы карбонильного соединения с образованием аниона альдоля:
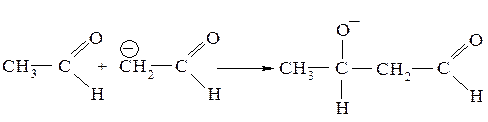
Образовавшийся анион неустойчив (сопряжение отсутствует) и стабилизируется, присоединяя протон от молекулы воды:

СН-кислотами могут быть только вещества, имеющие атомы водорода α-углеродного атома. Так, бензойный альдегид, не имеющий таких атомов, под действием растворов щелочей альдолей не образует, а дает реакцию Канниццаро, при которой одна молекула альдегида восстанавливается в бензиловый спирт, а вторая окисляется в бензойную кислоту, дающую со щелочью соль:
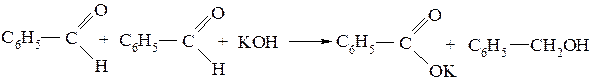
Особенно отчетливо СН-кислотность проявляется у соединений β-оксикислот, β-аминокислот и других, содержащих метиленовую группу между двумя электроноакцепторными заместителями. В этом случае протон у α-углеродного атома достаточно легко отщепляется и молекула превращается в карбанион:
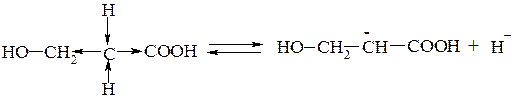
Этим обусловливаются специфические реакции таких соединений.
Задача № 3. Сравните основные свойства метиламина, диметиламина и анилина.
Эталон решения. К основаниям в соответствии с протолитической теорией относятся соединения − акцепторы протонов. Связывание протонов органическими соединениями может осуществляться либо за счет неподеленной пары электронов, либо за счет электронов π-связи.
Наиболее четко основные свойства выражены в ряду аминов − соединений, содержащих заместители:
–NH2; –NHCH3; 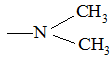
Химические свойства аминов во многом определяются наличием у атома азота неподеленной пары электронов, что придает им сходство с аммиаком. Так, при растворении алифатических аминов в воде происходит присоединение протона, а избыточные гидроксильные ионы обусловливают щелочную реакцию раствора:
CH3–NH2+HOH→[CH3–NH3]+OH−
Ион [CH3-NH3]+ следует рассматривать как комплексный ион, центральным атомом в котором является азот с координационным числом, равным четырем, а атомы водорода или алкилы расположены во внутренней координационной сфере.
Основные свойства аминов проявляются в их способности взаимодействовать с кислотами с образованием солей:
CH3–NH2+HCl→[CH3–NH3]Cl
Соли аминов − твердые кристаллические вещества, хорошо растворимые в воде. Щелочи, как более сильные основания, вытесняют амины из солей:
[CH3 – NH3]Cl + NaOH → CH3 –NH2 + NaCl + H2O
Вследствие +І-эффекта углеводородных радикалов амины являются более сильными основаниями, чем аммиак.
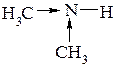
Введение третьей алкильной группы вызывает уменьшение основности, что объясняется пространственными затруднениями из-за экранирующего влияния трех алкильных групп.
Особенно сильными свойствами обладают четвертичные аммониевые основания, которые по силе сопоставимы со щелочами:
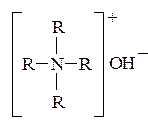
Основные свойства ароматических аминов выражены гораздо слабее, чем алифатических. Это обусловлено сопряжением неподеленной электронной пары атома азота с электронной системой ядра:

В результате электронная плотность у атома азота оказывается пониженной и его способность присоединять протон ослабляется. В этом случае присоединение протона ведет к уменьшению атомов, участвующих в сопряжении, и, следовательно, к меньшей делокализации электронов, т.е. является энергетически невыгодным.
Водный раствор ароматических аминов не изменяет окраску индикаторов, они не образуют соли со слабыми кислотами. При взаимодействии с сильными кислотами происходит образование солей:
C6H5–NH2 + HCl → [C6H5–NH3]+Cl-
Электроноакцепторные заместители уменьшают основность ароматических аминов, а электронодонорные − увеличивают ее.
Задача №4. Какой из гетероциклов − пиррол или пиридин − является более сильным основанием?
Эталон решения. Основные свойства присущи азотсодержащим гетероциклическим соединениям. При этом основность в значительной мере зависит от того, вступает ли неподеленная пара электронов в сопряжение с электронами углеродных атомов цикла или нет. Так, у пиррола основные свойства выражены крайне слабо, поскольку спаренные электроны азота участвуют в сопряжении, вследствие чего создается ароматический характер кольца и затрудняется присоединение протона к атому азота.
В молекуле пиридина сопряженная система образована без участия неподеленной пары; азота, поэтому пиридин ведет себя аналогично алифатическим аминам.


пиррол пиридин
Водный раствор пиридина имеет щелочную реакцию:
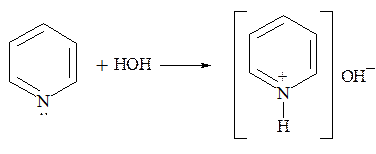
С минеральными и органическими кислотами пиридин образует кристаллические соли:
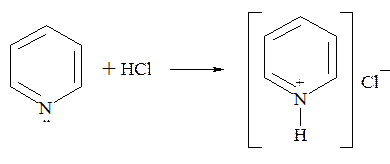
Для соединений, содержащих группы основного и кислотного характера, присуще образование внутренних солей, в которых протоны, возникающие при диссоциации кислотной группировки, связываются основной группой:
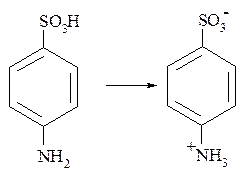
сульфаниловая кислота
Внутренние соли образуются также аминокислотами, фосфатидами и т.д.
Протон может присоединяться неподеленной парой электронов кислородного атома спиртов, альдегидов, эфиров и т.д. При этом образуются оксониевые основания - алкильные производные иона гидроксония:
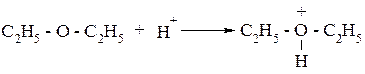
Оксониевые основания, как и ион гидроксония, неустойчивы, они являются промежуточными продуктами во многих реакциях (особенно при кислотном катализе), в частности при получении простых эфиров из спиртов и сложных эфиров из спиртов и кислот.
Дата добавления: 2016-03-22; просмотров: 3403;
