Особенности катализа
Приведенные примеры позволяют сформулировать общие свойства каталитических процессов.
1. Основное из них состоит в том, что в суммарное уравнение реакции катализатор не входит.
2. Отсюда вытекает ряд принципиальных следствий.
а)В ходе реакции катализатор не расходуется (то, что отмечалось нами в самом определении катализатора).
 |
б) Результирующее изменение энергии Гиббса в обоих вариантах реакции (без катализатора ис катализатором) одно и то же:
в) Если реакция — обратимая, то из предыдущего утверждения следует, что не меняется и константа равновесия (поскольку она непосредственно связана с 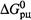 ):
):
 |
Иными словами, катализатор не сдвигает положения равновесия в обратимой реакции.
г) Но Kр = kпр /kобр. Поэтому, если в присутствии катализатора Kр остается неизменной, а kпр возрастает, то точно в такое же число раз возрастает и kобр,
т.е. скорости прямой и обратной реакций увеличиваются в одинаковой степени.
д) Два последних утверждения можно объединить в одно: катализатор только ускоряет (за счет увеличения kпр и kобр) достижение того же (что и в его
отсутствие) положения равновесия.
3. Итак, катализатор не входит в суммарное уравнение реакции. Но, как мы
видели из примеров, он непосредственно участвует в тех илииных промежуточных реакциях.
Следовательно, механизм катализа состоит в том, что исходная реакция
(с низкой константой скорости) заменяется на серию других (с более высокими
константами скорости).
Дата добавления: 2016-03-20; просмотров: 787;
