Химическая иммобилизация ферментов
При этом путем химического воздействия на структуру фермента в его молекуле создаются новые ковалентные связи (между белком и носителем). Ковалентная связь обеспечивает высокую прочность конъюгата. При этом существенно изменяется субстратная специфичность, каталитическая активность и стабильность фермента.
 При химической иммобилизации фермент отдален от носителя благодаря «ножке». Для этого применяют сшивающие агенты различной длины, чаще всего это глутаровый альдегид:
При химической иммобилизации фермент отдален от носителя благодаря «ножке». Для этого применяют сшивающие агенты различной длины, чаще всего это глутаровый альдегид:
В процессе ковалентной иммобилизации должны участвовать только те группы молекулы фермента, которые несущественны для его функции. Эти группы должны быть высокореакционноспособными. Наиболее реакционноспособными группами в белках являются SH-группы цистеина. Они участвуют в реакциях окисления, ацилирования, алкилирования и т.д. Однако в белках свободных SH-групп недостаточно, так как они участвуют в образовании дисульфидных мостиков или необходимы для каталитической активности фермента. Поэтому используют аминогруппы. Они достаточно реакционноспособны, обычно играют второстепенную роль в поддержании структуры и функции ферментов. Используют также имидазольные, гуанидиновые и гидроксильные группы.
Приёмы химической иммобилизации:
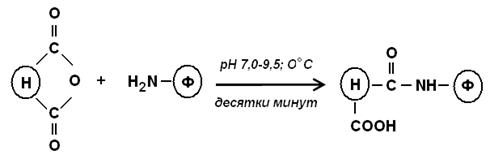
1. Реакция образования амидной связи. Часто применяют реакцию ацилирования аминогрупп фермента, используя:
а) ангидриды карбоновых кислот:
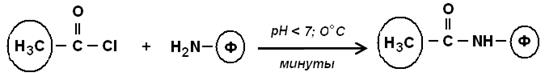
б) хлорангидриды карбоновых кислот:
2. Реакция образования карбамидных связей. Для этого часто используют бромциановый метод. При обработке бромцианом на природных носителях (или синтетических полиолах) образуются очень реакционноспособные группы:


цианатные и имидокарбонатные
При взаимодействии белка с таким активированным носителем образуются:
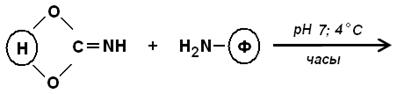
а) изомочевиныб) уретаны

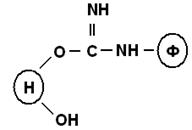
Бромциановым методом иммобилизуют аспарагиназу, ацетилхолинэстераза, холинэстераза.
3. Реакции образования вторичных аминов – α- и ε-аминогруппы белков можно трансформировать во вторичные в реакциях алкилирования и арилирования, а также путем восстановления азометиновых связей (оснований Шиффа). Алкилирующими и арилирующими агентами служат галогенпроизводные алифатических и ароматических углеводородов, а также метилалканов:

В таких условиях алкилируются тиольные, имидазольные и гидроксильные группы. Окислительное арилирование осуществляют с помощью бензохинона:
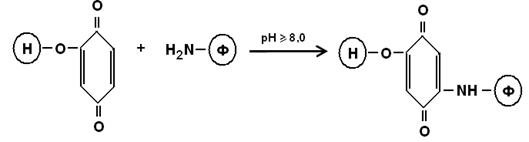
4. Реакции тиол-дисульфидного обмена – основаны на формировании межмолекулярных дисульфидных связей боргидридом натрия, меркаптоэтанолом, цистеином и др.:
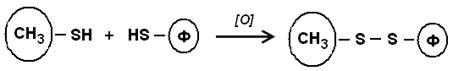

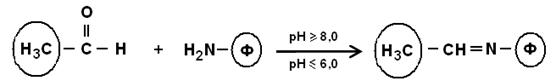
5. Модификация аминогрупп с образованием азометиновых связей
в реакциях белков с альдегидами. Такие связи легко разрушаются в кислых средах с регенерацией исходных веществ:
Дата добавления: 2016-02-27; просмотров: 2823;
