Кислота салициловая, натрия салицилат. Диэтиламиноацетанилиды: тримекаина гидрохлорид, лидокаина гидрохлорид. Местные анестетики: бупивакаин, артикаина гидрохлорид ( Ультракаин ).
Производные пара-аминофенола. Парацетамол. Ароматические кислоты и их производные. Кислота бензойная, натрия бензоат.
Кислота салициловая, натрия салицилат. Диэтиламиноацетанилиды: тримекаина гидрохлорид, лидокаина гидрохлорид. Местные анестетики: бупивакаин, артикаина гидрохлорид ( Ультракаин ).
В процессе поиска синтетических заменителей жаропонижающего средства хинина было обращено внимание на анилин, также обладающий жаропонижающими свойствами. Однако он был слишком токсичен. Для снижения токсичности было предложено заблокировать аминогруппу остатком уксусной кислоты. Получился препарат ацетанилид, значительно менее токсичный. Под названием антифебрин долгое время применялся в медицине:
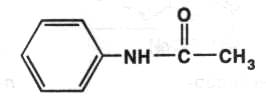
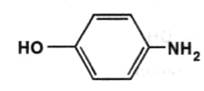 Заблокированная аминогруппа омыляется постепенно и поэтому не даёт сразу сильнотоксичного эффекта. Однако длительный приём этого средства мог привести к отравлению, поэтому этот препарат остался только в ветеринарной практике. Дальнейшими исследованиями было установлено, что в организме молекула анилина окисляется до пара-аминофенола:
Заблокированная аминогруппа омыляется постепенно и поэтому не даёт сразу сильнотоксичного эффекта. Однако длительный приём этого средства мог привести к отравлению, поэтому этот препарат остался только в ветеринарной практике. Дальнейшими исследованиями было установлено, что в организме молекула анилина окисляется до пара-аминофенола:
Это позволяет взаимодействовать с глюкуроновой кислотой и выводиться из организма с мочой. Однако пара-аминофенол не обладает жаропонижающим действием. Было предложено “защитить” функциональные группы, что привело к созданию фенацетина:
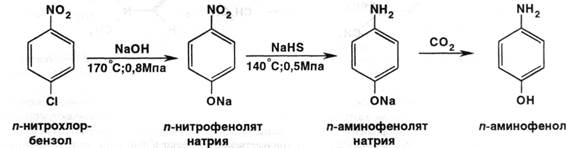 |
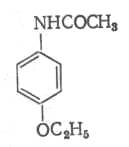 Он оказывает более слабое гемолитическое действие, но обладает достаточным жаропонижающим действием. Наличие этоксигруппы придаёт лёгкое наркотическое действие. Принцип изучения метаболизма анилина в организме и создание физиологически активных веществ путём преобразования анилина стал известен в литературе как “принцип фенацетина“. Сам фенацетин был снят с производства и исключён из реестра лекарственных средств России в 1995 году в связи с достаточно высокой токсичностью. Из этой группы в настоящее время широко применяется парацетамол под многочисленными названиями – панадол, эффералган, тайленол и др. ( более 100 ). Имеется несколько путей синтеза парацетамола. Например, из пара-нитрохлорбензола:
Он оказывает более слабое гемолитическое действие, но обладает достаточным жаропонижающим действием. Наличие этоксигруппы придаёт лёгкое наркотическое действие. Принцип изучения метаболизма анилина в организме и создание физиологически активных веществ путём преобразования анилина стал известен в литературе как “принцип фенацетина“. Сам фенацетин был снят с производства и исключён из реестра лекарственных средств России в 1995 году в связи с достаточно высокой токсичностью. Из этой группы в настоящее время широко применяется парацетамол под многочисленными названиями – панадол, эффералган, тайленол и др. ( более 100 ). Имеется несколько путей синтеза парацетамола. Например, из пара-нитрохлорбензола:
Далее пара-аминофенол ацетилируют ангидридом уксусной кислоты:
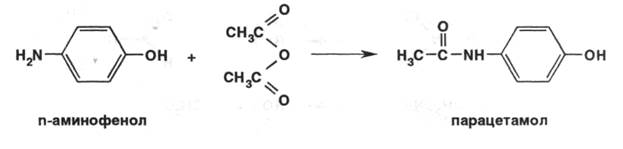
Другой путь получения – из фенола. Вначале получают пара-нитрозофенол действием нитрита натрия в сернокислой среде, затем восстанавливают в среде сероводорода ( получается пара-аминофенол ), далее процесс ацетилирования.
Paracetamolum ( Paracetamol ). Парацетамолфармакопейный препарат
п-Ацетаминофенол
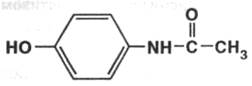 Описание:белый или белый с кремоватым или розоватым оттенком кристаллический порошок без запаха.
Описание:белый или белый с кремоватым или розоватым оттенком кристаллический порошок без запаха.
Растворимость: трудно растворим в воде, легко растворим в 95% спирте, растворим в ацетоне и растворах едких щелочей, практически нерастворим в эфире.

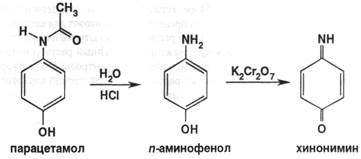 Подлинность: по ГФX 1) реакция на фенольный гидроксил – 0,1 г препарата взбалтывают с 10 мл воды и прибавляют несколько капель раствора хлорида окисного железа (III); появляется сине-фиолетовое окрашивание; 2) 0,05 г препарата кипятят с 2 мл разведённой хлороводородной кислоты 1 минуту, прибавляют 10 мл воды, охлаждают и прибавляют 1 каплю раствора бихромата калия; появляется фиолетовое окрашивание, не переходящее в красное ( отличие от фенацетина ). Реакция основана на гидролизе, окислении и образовании индофенола:
Подлинность: по ГФX 1) реакция на фенольный гидроксил – 0,1 г препарата взбалтывают с 10 мл воды и прибавляют несколько капель раствора хлорида окисного железа (III); появляется сине-фиолетовое окрашивание; 2) 0,05 г препарата кипятят с 2 мл разведённой хлороводородной кислоты 1 минуту, прибавляют 10 мл воды, охлаждают и прибавляют 1 каплю раствора бихромата калия; появляется фиолетовое окрашивание, не переходящее в красное ( отличие от фенацетина ). Реакция основана на гидролизе, окислении и образовании индофенола:
Непрореагировавший пара-аминофенол при взаимодействии с хинонимином образует индофенол;
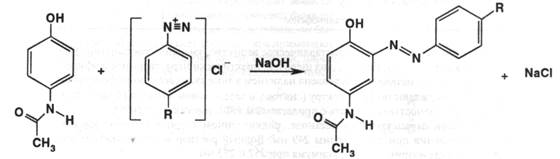 3) 0,1 г препарата осторожно кипятят с 2 мл разведённой серной кислоты в течение 2 минут; появляется запах уксусной кислоты. По ФС подлинность подтверждают по ИК-спектру, снятому в вазелиновом масле; он должен совпадать с рисунком, приложенным к ФС. Также по УФ-спектру, снятому в разных растворителях: 0,0005% раствор препарата в смеси метанол-хлороводородная кислота – максимум поглощения при 249 нм; в воде при 243 нм; 0,001 М в гидроксиде натрия – при 257 и 273 нм. Парацетамол образует азосоединение с диазореактивом ( красного цвета ) в орто-положении по отношению к фенольной группе:
3) 0,1 г препарата осторожно кипятят с 2 мл разведённой серной кислоты в течение 2 минут; появляется запах уксусной кислоты. По ФС подлинность подтверждают по ИК-спектру, снятому в вазелиновом масле; он должен совпадать с рисунком, приложенным к ФС. Также по УФ-спектру, снятому в разных растворителях: 0,0005% раствор препарата в смеси метанол-хлороводородная кислота – максимум поглощения при 249 нм; в воде при 243 нм; 0,001 М в гидроксиде натрия – при 257 и 273 нм. Парацетамол образует азосоединение с диазореактивом ( красного цвета ) в орто-положении по отношению к фенольной группе:
Чистота: по ГФX определяется кислотность (появляется за счёт разложения препарата и выделения уксусной кислоты), наличие исходного продукта синтеза пара-аминофенола, потеря веса при высушивании.
Допустимые примеси: сульфатная зола и тяжёлые металлы, сульфаты и хлориды – в пределах эталона.
По ФС проводят испытания на примеси промежуточных продуктов синтеза (пара-хлорацетанилида и пара-аминофенола ) методом ТСХ на пластинках “Силуфол УФ-254” со стандартными образцами примесей. Осмотр результатов проводят в УФ-свете при длине волны 254 нм. Пара-аминофенол определяют путём реакции в сравнении с образцом парацетамола, не имеющего примеси. Образующаяся окраска испытуемого образца не должна быть интенсивнее контрольного раствора.
Количественное определение: предложено много методов, в том числе нейтрализация после гидролиза выделившейся уксусной кислоты; парацетамол проявляет слабые кислотные свойства, поэтому может быть определён неводным титрованием в среде безводного ацетона, титрант – гидроксид калия в изопропиловом спирте. В этом случае точка эквивалентности устанавливается потенциометрически.
По ГФX метод нитритометрии, по продукту кислотного гидролиза ( гидрохлорид пара-аминофенола ). Образовавшийся после 1 часа кипячения с обратным холодильником пара-аминофенол титруют нитритом натрия в среде хлороводородной кислоты при внешнем индикаторе йодкрахмальной бумажке:
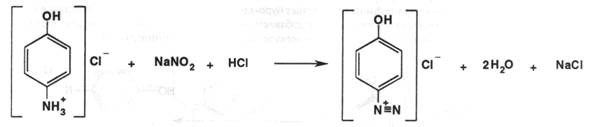 NaNO2 + HCIà NaCl + HNO2
NaNO2 + HCIà NaCl + HNO2
Вначале натрия нитрит идёт на образование соли пара-гидроксибензолдиазония хлорида. В точке эквивалентности ( когда в растворе не останется пара-аминофенола ) избыточный натрия нитрит реагирует с калия йодидом ( содержащимся в йодкрахмальной бумажке ), происходит выделение йода, который тотчас окрашивает крахмал внешнего индикатора:
2NaNO2 + 2KI + 4HC1 à I2 + 2NO + 2KC1 + 2H2O+2NaC1
Реакция образования соли диазония идёт во времени, поэтому титровать надо по методике, медленно. Для стабилизации неустойчивой соли диазония в раствор до титрования добавляют калия бромид, а само титрование ведут при температуре не выше 200 С.
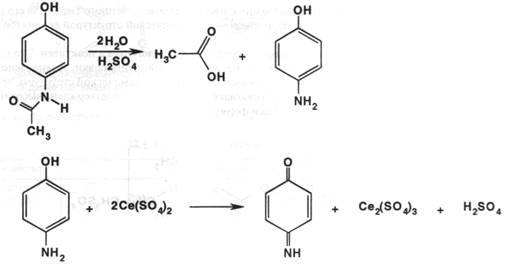 Возможен обратный цериметрический метод ( по ЕФ ) после предварительного омыления препарата до пара-аминофенола и его окисления 0,1 М раствором сульфата церия (IV):
Возможен обратный цериметрический метод ( по ЕФ ) после предварительного омыления препарата до пара-аминофенола и его окисления 0,1 М раствором сульфата церия (IV):
Избыток сульфата церия (IV) взаимодействует с добавленным 10% раствором калия йодида с выделением свободного йода. Свободный йод оттитровывается 0,1 М раствором тиосульфата натрия ( индикатор – крахмал ):
2Ce(SO4)2 + 2KI à I2 + Ce2(SO4)3 + K2SO4
¯ I2 + 2Na2S2O3 = 2NaI + Na2S4O6
В таблетках по ФС парацетамол определяют спектрофотометрически при 257 нм (максимум поглощения) в 0,1 М растворе гидроксида калия.
Хранение: по списку Б; в хорошо укупоренной таре в сухом месте, предохраняя от действия света, вызывающего гидролиз. В.р.д. внутрь 0,5 г; в.с.д. внутрь 1,5 г.
Применение: жаропонижающее, болеутоляющее.
Форма выпуска: порошок, таблетки по 0,2 и 0,5 г, сиропы, многочисленные многокомпонентные лекформы, содержащие парацетамол.
Ароматические кислоты и их соли
Ароматические кислоты – это производные ароматических углеводородов, у которых в бензольном ядре один или несколько атомов водорода заменены на карбоксильные группы. Простейшим представителем гомологического ряда является кислота бензойная, она немного слабее по кислотным свойствам уксусной кислоты. Салициловая кислота, имеющая в своём составе фенольный гидроксил, намного сильнее уксусной кислоты. При взаимодействии со щелочами бензойная и салициловая кислоты образуют соли, которые хорошо растворимы в воде. В водных растворах они диссоциируют как соли слабых кислот и сильного основания. Синтезируют кислоту бензойную несколькими путями. Возможно окисление толуола различными окислителями:

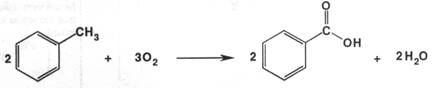 Более современный способ получения основан на жидкофазном окислении толуола кислородом воздуха при 1500 С и повышенном давлении:
Более современный способ получения основан на жидкофазном окислении толуола кислородом воздуха при 1500 С и повышенном давлении:
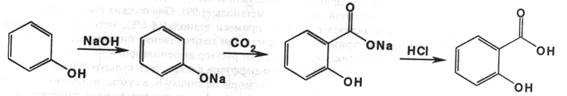 Салициловую кислоту получают карбоксилированием фенола:
Салициловую кислоту получают карбоксилированием фенола:
Сухую смесь фенола и гидроксида натрия нагревают до 1300 С при давлении 5 атмосфер с диоксидом углерода. Далее продукт реакции растворяют в воде и подкисляют хлороводородной кислотой. Салициловую кислоту перекристаллизовывают.
Acidum benzoicum. Кислота бензойнаяфармакопейный препарат
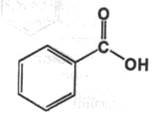
Описание: бесцветные игольчатые кристаллы или белый мелкокристаллический порошок. При нагревании возгоняется; перегоняется с водяным паром.
Растворимость: мало растворим в воде, растворим в кипящей воде, легко растворим в спирте, хлороформе, эфире и бензоле, растворим в жирных маслах.
Подлинность: по ГФX даёт реакцию с раствором хлорида железа (III). Предварительно кислоту растворяют в 0,1 М растворе гидроксида натрия до нейтральной среды. Результат реакции – нерастворимый в воде основной бензоат железа розово-жёлтого цвета:
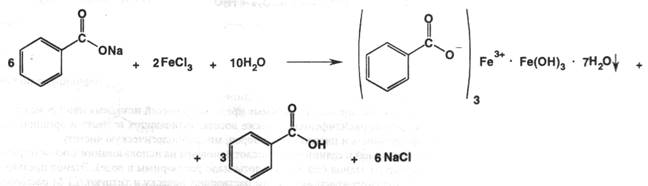
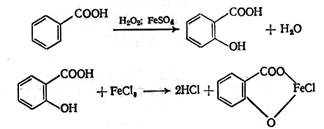 Другая нефармакопейная реакция – получение из бензойной кислоты салициловой под действием перекиси водорода в присутствии катализатора сульфата железа (II) при кипячении. Салициловая кислота обнаруживается по реакции с хлоридом железа (III) по фиолетовому окрашиванию раствора:
Другая нефармакопейная реакция – получение из бензойной кислоты салициловой под действием перекиси водорода в присутствии катализатора сульфата железа (II) при кипячении. Салициловая кислота обнаруживается по реакции с хлоридом железа (III) по фиолетовому окрашиванию раствора:
Чистота: также ГФX предлагает проводить испытания на прозрачность и цветность раствора. ФС предлагает определять микробиологическую чистоту.
Допустимые примеси: лимитирует наличие восстанавливающих веществ, легкообугливающихся примесей ( по эталону цветности 5 а – 5 г ), хлоридов, сульфатов, сульфатная зола должна выдерживать испытания на тяжёлые металлы.
Количественное определение: по ГФХ препарат растворяют в нейтрализованном по фенолфталеину спирте и титруют при этом же индикаторе гидроксидом натрия до розового окрашивания. Действующего вещества 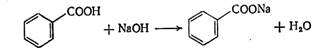 в препарате должно быть не менее 99,5%.
в препарате должно быть не менее 99,5%.
Хранение: в хорошо укупоренной таре ( летуча ).
Применение: как слабый антисептик в мазях. Чаще используют натриевую соль.
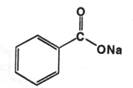 Natrii benzoas. Натрия бензоатфармакопейный препарат
Natrii benzoas. Натрия бензоатфармакопейный препарат
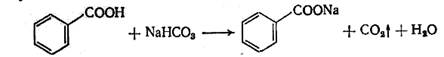 Получение: по реакции нейтрализации бензойной кислоты содой:
Получение: по реакции нейтрализации бензойной кислоты содой:
Описание: белый кристаллический порошок без запаха, сладковато-солёного вкуса.
Растворимость: легко растворим в воде, трудно растворим в спирте.
Подлинность: по ГФX – 1) препарат даёт характерную реакцию а) на натрий, окрашивая бесцветное пламя в жёлтый цвет б) на бензоаты – с хлоридом железа (III) выпадает осадок телесного цвета. 2) препарат растворяют в воде, прибавляют 1 мл азотной кислоты; выделившиеся белые кристаллы бензойной кислоты отфильтровывают, высушивают в эксикаторе и определяют температуру плавления ( 120-124,50 С ). Характерной, но нефармакопейной реакцией является взаимодействие с 5% раствором сульфата меди – выпадает осадок бирюзового цвета. По ФС идентификация происходит методом УФ-спектрофотометрии в области 220-230 нм в водном растворе; он должен иметь максимум поглощения при 226 нм.
ГФX предлагает проводить испытания на прозрачность и цветность раствора, щелочность и кислотность, потерю в весе при высушивании. ФС предлагает определять микробиологическую чистоту.
Допустимые примеси: хлориды, сульфаты, тяжёлые металлы.
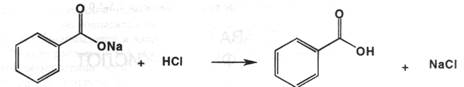 Количественное определение: ацидиметрическим методом. Титрант – хлороводородная кислота, индикатор – смесь метилового оранжевого и метиленового синего. Титрование необходимо проводить в присутствии эфира, который извлекает образующуюся бензойную кислоту в эфирный слой. Ибо в растворе достаточно сильная бензойная кислота будет менять рН водного раствора в кислую сторону, что будет сильно искажать результаты титрования:
Количественное определение: ацидиметрическим методом. Титрант – хлороводородная кислота, индикатор – смесь метилового оранжевого и метиленового синего. Титрование необходимо проводить в присутствии эфира, который извлекает образующуюся бензойную кислоту в эфирный слой. Ибо в растворе достаточно сильная бензойная кислота будет менять рН водного раствора в кислую сторону, что будет сильно искажать результаты титрования:
Хранение: в хорошо укупоренной таре.
Применение: отхаркивающее средство.
Форма выпуска: порошок.
Acidum salicylicum. Кислота салициловаяфармакопейный препарат
о-Оксибензойная кислота
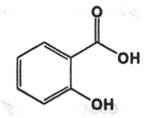 В природе встречается в свободном состоянии в цветках ромашки, в листьях кассии. В виде метилового эфира содержится во многих эфирных маслах.
В природе встречается в свободном состоянии в цветках ромашки, в листьях кассии. В виде метилового эфира содержится во многих эфирных маслах.
Описание: белые мелкие игольчатые кристаллы или лёгкий кристаллический порошок без запаха. Летуч с водяным паром. При острожном нагревании возгоняется.
Растворимость: мало растворим в воде, растворим в кипящей воде, легко растворим в спирте, эфире, трудно растворим в хлороформе.
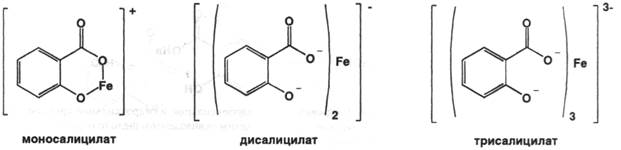 Подлинность: по ГФX 1) 0,01 г препарата растворяют в 10 мл воды. К полученному раствору прибавляют 1 каплю хлорида окисного железа; появляется сине-фиолетовое окрашивание, исчезающее от прибавления нескольких капель разведённой хлороводородной кислоты и неисчезающее от прибавления нескольких капель разведённой уксусной кислоты:
Подлинность: по ГФX 1) 0,01 г препарата растворяют в 10 мл воды. К полученному раствору прибавляют 1 каплю хлорида окисного железа; появляется сине-фиолетовое окрашивание, исчезающее от прибавления нескольких капель разведённой хлороводородной кислоты и неисчезающее от прибавления нескольких капель разведённой уксусной кислоты:
Именно моносалицилат имеет сине-фиолетовое окрашивание, что зависит от рН среды – 2-3. Дисалицилат при рН 3-8 красного цвета, а трисалицилат при рН 8-10 жёлтого цвета.
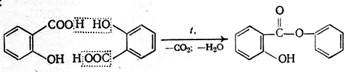
2) 0,1 препарата нагревают с 0,3 г цитрата натрия; ощущается запах фенола – происходит декарбоксилирование. 3) 1 г препарата нагревают с 2 мл концентрированной серной кислоты и выделяющийся газ пропускают через известковую воду; появляется муть (происходит декарбоксилирование):
 Ca(ОН)2 + СО2 = СаСО3 + Н2О
Ca(ОН)2 + СО2 = СаСО3 + Н2О
Образуется фениловый эфир салициловой кислоты:
Из нефармакопейных реакций наиболее интересна реакция с раствором сульфата меди, образуется комплекс зелёного цвета ( предварительно салициловую кислоту нейтрализуют щёлочью ).
Дата добавления: 2016-02-04; просмотров: 7774;
