Окислительно-восстановительные реакции и их роль в жизненных процессах. Перманганатометрия, ее применение в санитарно-гигиенических и клинических исследованиях.
Окисли́тельно-восстанови́тельные реа́кции (ОВР) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
Окисление Окисление - процесс отдачи электронов, с увеличением степени окисления.
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества, называются донорами электронов, а атомы окислителя —акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
окислитель + e− ↔ сопряжённый восстановитель.
Восстановление Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента.
ПЕРМАНГАНАТОМЕТРИЯ, титриметрич. метод анализа, основанный на р-циях: 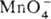 + 8H+ + 5е
+ 8H+ + 5е 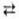 4H2O + Mn2+ и
4H2O + Mn2+ и 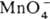 + 4H2O + Зе
+ 4H2O + Зе 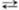 MnO2 + 4OH— (стандартные электродные потенциалы соотв. +1,52 и +0,57 В). Титрантом служит водный р-р KMnO4, к-рый в чистом виде очень устойчив и долго хранится. Однако в присут. Mn(II) происходит р-ция:
MnO2 + 4OH— (стандартные электродные потенциалы соотв. +1,52 и +0,57 В). Титрантом служит водный р-р KMnO4, к-рый в чистом виде очень устойчив и долго хранится. Однако в присут. Mn(II) происходит р-ция: 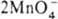 + 3Mn2+ + 2H2O
+ 3Mn2+ + 2H2O 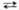 5MnO2 + 4H+, к-рая ускоряется диоксидом марганца и при понижении кислотности р-ра. Поскольку перманганат калия всегда содержит трудно удаляемые примеси, свежеприготовленный р-р KMnO4 кипятят в течение часа, фильтруют через стеклянный фильтр и хранят в темных склянках, в защищенных от прямого солнечного света местах (т.к. на свету ускоряется разложение KMnO4 на MnO2 и O2).
5MnO2 + 4H+, к-рая ускоряется диоксидом марганца и при понижении кислотности р-ра. Поскольку перманганат калия всегда содержит трудно удаляемые примеси, свежеприготовленный р-р KMnO4 кипятят в течение часа, фильтруют через стеклянный фильтр и хранят в темных склянках, в защищенных от прямого солнечного света местах (т.к. на свету ускоряется разложение KMnO4 на MnO2 и O2).
Для определения концентрации титранта используют р-ры с точно известным содержанием (стандартные р-ры) Na2C2O4, As2O3 (в присут. ICl или KIO3 в качестве катализатора), FeS04·(NH4)2SO4·6H2O и K4[Fe(CN)6]·3H2O. Конечную точку титрования в перманганатометрии устанавливают обычно визуально безиндикатора по появлению или исчезновению окраски перманганат-иона (даже 2·10-6 M р-р KMnO4 имеет отчетливую розовую окраску), потенциометрически или амперометрически. При обратном титровании к исследуемому р-ру приливают р-р KMnO4, избыток к-рого от-титровывают р-ром восстановителя, напр. щавелевой к-ты.
Перманганатометрию применяют для определения Fe(II), Sb(III), Mn(II), V(IV), W(V), U(IV), Tl(I), Cr(III), H2O2, H2C2O4 и ее солей, арсенитов, гидразина и ряда орг. в-в (напр., хлоруксусной и пропионовой к-т в щелочной среде); обратным пермангана-тометрич. титрованием определяют восстановители, медленно реагирующие с KMnO4, - иодиды, цианиды, родани-ды, фосфиты.
Перманганатометрию используют также для косвенных определений. Напр., концентрации очень сильныхвосстановителей, окисляющихся в обычных условиях растворенным кислородом, - Cr (II), V(II), Ti(III), Nb(III), Mo(III), Cu(I), Sn(II) и др. - устанавливают после их взаимод. с ионами Fe(III) по кол-ву образовавшихся ионов Fe (II), к-рые оттитровывают р-ром KMnO4. Ионы таких металлов, как Ca, Cd, Zn, Pb(Il), Со, Ni, РЗЭ, определяют после их осаждения в виде оксалатов. К перманганатометрии часто относят обратное ферриметрич.титрование, в к-ром при определении окислителей (дихроматов, персульфатов, ванадатов, MnO2, PbO2, Pb3O4 и др.) их предварительно восстанавливают с помощью Fe(II), избыток к-рого оттитровывают р-ром KMnO4.
37.Определение направления окислительно-восстановительных реакций по стандартным значениям ∆С- образования реагентов.
О направлении ОВР можно судить по изменению энергии Гиббса ∆G. Если ∆G < 0 – реакция возможна, если ∆G > 0 - невозможна. Из термодинамики известно, что ∆G = -n·F·E; E = φок-ля -φв-ля или φок-ля > φв-ля, что возможно при Е > 0 и ∆G < 0.
Рассмотрим реакцию:
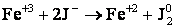 .
.
Она состоит из двух полуреакций:
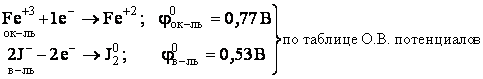
|
.
Т.к. φок-ля > φв-ля, то возможно самопроизвольное протекание реакции слева направо.
2FeCl3 + 2KJ → 2FeCl2 + J2 + 2KCl
Из всех возможных при данных условиях О.В.Р. в первую очередь протекает та, которая имеет наибольшую разность окислительно – восстановительных потенциалов.
О.В.Р. протекают в сторону образования более слабых окислителей и восстановителей из более сильных.
Качественное определение направления протекания окислительно-восстановительных процессов заключается в сравнении значений стандартных окислительно-восстановительных потенциалов различных редокс-пар. При этом исходят из следующих положений:
- стандартные окислительно-восстановительные потенциалы являются количественной характеристикой как процесса восстановления, так и обратного ему процесса – окисления;
- окисленная форма редокс-пары с большим значением
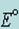 играет роль окислителя по отношению к восстановленной форме пары с меньшим значением
играет роль окислителя по отношению к восстановленной форме пары с меньшим значением 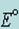 ;
; - чем больше
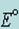 , тем более четко выражена окислительная способность системы и тем меньше – ее восстановительная способность;
, тем более четко выражена окислительная способность системы и тем меньше – ее восстановительная способность; - окислительно-восстановительная реакция будет протекать в прямом направлении только в том случае, если электродвижущая сила реакции (ЭДС), вычисляемая как
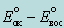 , имеет положительное значение, причем чем больше ЭДС, тем интенсивнее протекает реакция;
, имеет положительное значение, причем чем больше ЭДС, тем интенсивнее протекает реакция; - окислительно-восстановительные процессы идут в направлении образования более слабых окислителей и восстановит
38. Основные положения квантовой механики. Волновая функция. Квантово-механическая модель атома. Атомная орбиталь.
Открытия в физике конца XIX – начала XX веков привели к коренному изменению сложившихся представлений классической физики и созданию современной физики. Ее облик в основном определила квантовая механика, описывающая движение микрочастиц и микросистем: электронов, атомов, ядер и молекул.
Основные принципы квантовой механики были сформулированы в результате анализа и обобщения данных многих экспериментов. Остановимся напринципе квантования, который собственно и дал название теории. Его суть заключается в том, чтосвойства микрочастиц и их систем (микросистем) невозможно описать без использования дискретных величин, т.е. без квантования.
Сам факт существования микрочастиц говорит о дискретности материи, а отсюда недалеко до вывода о дискретности величин, описывающих микрочастицы. Принцип квантования подтверждается результатами опытов и выводами из них.
Волнова́я фу́нкция, или пси-функция 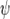 — комплекснозначная функция, используемая в квантовой механике для описания чистого состояния системы. Является коэффициентом разложения вектора состояния по базису (обычно координатному):
— комплекснозначная функция, используемая в квантовой механике для описания чистого состояния системы. Является коэффициентом разложения вектора состояния по базису (обычно координатному):
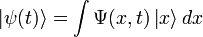
где 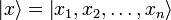 — координатный базисный вектор, а
— координатный базисный вектор, а  — волновая функция в координатном представлении.Физический смысл волновой функции заключается в том, что согласно копенгагенской интерпретации квантовой механики плотность вероятности нахождения частицы в данной точке конфигурационного пространства в данный момент времени считается равнойквадрату абсолютного значения волновой функции этого состояния в координатном представлении.
— волновая функция в координатном представлении.Физический смысл волновой функции заключается в том, что согласно копенгагенской интерпретации квантовой механики плотность вероятности нахождения частицы в данной точке конфигурационного пространства в данный момент времени считается равнойквадрату абсолютного значения волновой функции этого состояния в координатном представлении.
Дата добавления: 2016-01-16; просмотров: 4144;
