Дополнение. Гаусманнит и другие смешанные оксиды марганца
Смешанный оксид Mn3O4 содержит марганец в степенях окисления +2 и +4. Он встречается в виде минерала гаусманнита, образующего черные с металлическим блеском кристаллы. При измельчении они превращаются в черно-красный порошок. Оксид Mn3O4 образуется при нагревании до 1000 оС любых соединений марганца на воздухе или в кислороде. При этом он кристаллизуется в тетрагональной низкотемпературной модификации α-Mn3O4, идентичной природному гаусманниту. Она имеет структуру, близкую шпинели. Выше 1170 оС гаусманнит превращается в высокотемпературную кубическую β-форму со структурой нормальной шпинели. В ней ионы Mn3+ занимают только октаэдрические позиции. Действительно, для ионов с конфигурацией d4 характерна большая энергия стабилизации октаэдрическим окружением, 95 кДж/моль, показывающая предпочтение октаэдрических позиций по сравнению с тетраэдрическими. Это значение ЭСКП уступает только иону Cr3+ (158 кДж/моль). Поэтому все шпинели трехвалентного марганца относятся к нормальным шпинелям.
Mn3O4 образуется при термическом распаде диоксида, который при 550 оС переходит в Mn2O3, а при 950 – в Mn3O4. Термический распад сульфата MnSO4 выше 1000 оС или сплавление сульфата марганца(II) c поташом дают гаусманнит в виде красных кристаллов. Чистый Mn3O4 получают разложением карбоната марганца(II) в инертной атмосфере:
3MnСО3 = Mn3O4 + СO↑ + 2СО2↑.
Это вещество является также конечным продуктом при окислении гидроксида марганца(II) на воздухе.
Многие восстановители, например, водород и углерод, способны переводить его лишь в низший оксид MnO. Полное восстановление оксида марганца (II, IV) происходит только в присутствии железа, которое растворяет марганец.
При нагревании на воздухе гаусманнит окисляется до оксида марганца(III), а действием хлора на водную суспензию Mn3O4 удается получить оксид марганца(IV).
Восстановление гауманнита сернистым газом в газовой фазе и в растворе приводит к различным продуктам:
Mn3O4 + SO2 = 2MnO + MnSO4,
Mn3O4 + 2SO2 + 2H2SO4= 2MnSO4 + MnS2O6 + H2O.
В водных растворах кислот происходит диспропорционирование:
Mn3O4 + 4Н+ = MnO2 + 2Mn2+ + 2Н2О.
Благодаря наличию большого числа неспаренных электронов, гаусманнит обладает необычными магнитными свойствами. При изменении температуры он испытывает ряд магнитных переходов с упорядочением электронных спинов.
Интересно, что оксид Mn3O4 оказывает более слабое каталитическое действие на разложение пероксида водорода, чем оксиды марганца(II) и марганца(IV).
В системе марганец-кислород есть также промежуточный оксид Mn5O8, образующийся в виде тонких блестящих желтых пластинок при нагревании MnOОН в токе кислорода до 250 оС или из MnO в гидротермальных условиях при повышенном давлении кислорода. На основании изоструктурности с Cd2Mn3O8 ему приписана формула Mn2IIMn3IVO8, в его решетке ионы Mn4+ расположены в искаженных октаэдрах из атомов О на расстояниях 0,185-0,192 нм. Ионы Mn2+ находятся в искаженных тригональных призмах с тремя короткими, 0,213 нм, и тремя длинными, 0,230 нм, связями Mn-O (рис.5.14.Структура оксида Mn5O8). При нагревании на воздухе или в кислороде Mn5O8 переходит в α-Mn2O3.
КОНЕЦ ДОПОЛНЕНИЯ.
Низшие оксиды технеция и рения со степенями окисления ниже +4 неустойчивы и мало изучены. Диоксиды ЭО2 известны для всех трех металлов седьмой группы: у марганца это наиболее часто встречающийся в природе минерал пиролюзит. Красно-коричневый ТсО2 - самый устойчивый оксид технеция: он является конечным продуктом высокотемпературного разложения многих кислородных соединений. Сине-черный диоксид рения, несмотря на многие общие свойства с оксидом технеция(IV), при высоких температурах подвергается диспропорционированию на Re2O7 и металл.
К настоящему времени известно не менее четырнадцати соединений состава MnO2, представляющие собой порошки черно-коричневого цвета. Формально они считаются полиморфными модификациями диоксида, хотя их составы часто существенно отличаются от стехиометрического. Многие из этих фаз дефицитны по кислороду MnOх (1,7<x<2), часто содержат воду, ионы ОН–, катионы металлов, часть ионов Mn4+ в них может быть замещена на Mn2+. Например, в решетку α-MnO2, образовавшегося при окислении сульфата марганца(II) раствором персульфата аммония, встроены ионы NH4+, в ней содержится 91,5 % MnO2. Известны три модификации диоксида марганца стехиметрического состава – пиролюзит (β-MnO2), имеющий тетрагональную структуру типа рутила (Сноска: Известен также и пиролюзит нестехиометрического состава MnOх, х = 1,93 –2,00), рамсделлит, и λ-MnO2. Все они образованы октаэдрами MnO6, связанными в цепи или слои (Рис.5.15. Кристаллические структуры рамсделлита (а) и пиролюзита (б)). γ-Модификация диоксида, используемая для производства гальванических элементов, имеет состав MnO1,93. Она состоит из фрагментов структур рамсделлита и пиролюзита, и содержит большое число различных дефектов (J.-R. Hill, C.M. Freeman, M.H. Rossouw, J. Solid State Chem., 2004, 177, 165).
Среди многочисленных реакций образования MnO2 только некоторые предпочтительны, благодаря легкости проведения и воспроизводимости. К ним относятся окисление солей соединений марганца(II) растворами хлоратов, перманганатов, персульфатов, хлором и озоном
3Mn(OH)2 + NaClO3 = 3MnO2 + NaCl + 3H2O,
3MnCl2 + 2KMnO4 + 2H2O = 5MnO2 + 4HCl + 2KCl,
восстановление перманганатов действием пероксида водорода, соляной кислоты, сернистого газа, сульфитов, спиртов, солями марганца(II):
2KMnO4 + 3SO2 + 2H2O = 2MnO2 + 2KHSO4 + H2SO4
4KMnO4 + 3C2H5OH = 4MnO2 + KOH + 3CH3COOK + 4H2O.
Большая часть диоксида марганца выделяется в виде бурого осадка, однако, часть его остается в виде коллоидного раствора.
Описанные выше способы приводят к продукту, представляющему собой смесь различных модификаций MnO2. Для получения той или иной модификации в чситом виде используют особые методы синтеза. При термическим разложении нитрата Mn(NO3)2. ниже 350 °C образуется γ-модификация, при более высокой температуре - β-MnO2. При выдерживании вещества в токе О2 при 400-500 оС удается получить продукт стехиометрического состава. При электролитическом окислении растворов солей образуется нестехиометрическая γ-модификация, в продуктах сопропорционирования солей марганца(II) с перманганатами всегда присутствуют ионы Mn2+. При окислении соединений марганца(II) пероксидом водорода, хлором, бромом, гипогалогенатами, хлоратами, броматами, персульфатами образуется диоксид MnО2-х с дефицитом кислорода.
Получение пиролюзита восстановлением перманганата пероксидом водорода проводят в слабо кислом, нейтральном или щелочном растворе. При этом пероксид водорода необходимо брать в избытке, учитывая его каталитическое разложение образующимся пиролюзитом. В сильно кислой среде пероксид водорода восстанавливает пиролюзит до солей марганца(II):
MnO2 + H2O2 + 2H+ = Mn2+ + 2H2O + O2↑.
Диоксид марганца, как соединение промежуточной степени окисления, проявляет окислительные и восстановительные свойства. Для него более характерно поведение окислителя. При нагревании происходит внутримолекулярная окислительно-восстановительная реакция, сопровождающаяся выделением кислорода и постепенным понижением степени окисления марганца с последовательным образованием различных оксидов:
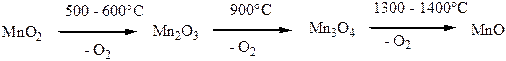
Процессы термического распада различных модификаций диоксида MnО2 протекают сложно и зависят от стехиометрии данного образца, его термической предыстории, а также от присутствия воды и других примесей, парциального давления О2, размера частиц. При постепенном нагревании MnО2 сначала отдает воду, полное обезвоживание достигается только при 600 оС. Одновременно в интервале 300-450 оС протекают полиморфные переходы между различными фазами MnО2 (например, γ-MnО2 превращается в β-MnО2 при 280-420 оС). При 500 – 600 оС MnО2 отщепляет кислород и переходит в Mn2О3, при 900 оС образуется Mn3О4 и О2, а при 1300 – 1400 оС – MnО. В присутствии кислорода разложение диоксида марганца происходит при большей температуре. При 1540 оС парциальное давление О2 над Mn3О4 достигает 0,1 атм.
Водородом диоксид восстанавливается до MnО, активные металлы, например, кальций или алюминий, а также ионные гидриды, восстанавливают его до металла:
3MnO2 + 4Al = 2Al2O3 + 3Mn, ΔH = - 1090 кДж/моль.
MnО2 + СаН2 = Mn + СаО + Н2О.
С сухим сероводородом реакция протекает очень быстро уже при комнатной температуре:
MnО2 + 2H2S = MnS + S + 2H2O.
При пропускании H2S через водную суспензию MnО2 образуется белесый осадок, состоящий из смеси сульфида марганца(II) и серы; в растворе присутствуют ионы SO42- и S2O32-.
Выше 300 оС тонко размельченный порошок MnO2 взаимодействует с сернистым газом: MnO2 + SO2 = MnSO4. В присутствии воды, наряду с сульфатом MnSO4, образуется дитионат MnS2O6 – это лабораторный метод синтеза дитионатов. Количество дитионата определяется модификацией диоксида: в случае β-MnО2 его выход достигает 97 %, а с α-MnО2 – 79 %. Тиосульфат в растворе при рН 4-5,8 окисляется пиролюзитом в сульфат и политионат:
3S2O32- + 4MnO2 + 6H+ = 2SO42- + S4O62- + 4Mn2+ + 3H2O.
Окислительные свойства диоксида марганца сильнее всего проявляются в сильно кислой среде, что следует из уравнения Нернста:
MnO2 + 4H+ + 2 e– ® Mn2+ + 2H2O, E0 = 1.23 B
E(MnO2/Mn2+) = 1.23 – 0.118pH.
В кислой среде пиролюзит восстанавливается гидразином до Mn2+:
2MnO2 + N2H4.H2SO4 + H2SO4 = 2MnSO4 + 4H2O + N2↑,
а в аммиачном растворе - лишь до Mn3+:
4MnO2 + N2H4.H2SO4 + 2NH3 = 4MnOOH + (NH4)2SO4 + N2↑.
Бромиды и иодиды в кислой среде восстанавливают оксид марганца(IV) в соли марганца(II), окисляясь до простых веществ:
Реакция с хлорид-ионами протекает лишь в сильно кислых концентрированных растворах при нагревании, например, при взаимодействии с концентрированной соляной кислотой:
80 °C
MnO2 + 4HCl = MnCl2 + Cl2↑ + 2H2O,
или хлоридом, подкисленным азотной кислотой:
100 оС
2NaCl + 4HNO3 + MnO2 = 2NaNO3 + Cl2↑ + Mn(NO3)2 + 2H2O.
При обработке диоксида марганца холодной концентрированной HCl наблюдается образование темного раствора, содержащего молекулы тетрахлорида MnCl4 – его образование зафиксировано при температуре ниже 0 оС. Постепенно раствор светлеет вследствие распада тетрахлорида на хлор и MnCl2.
В плавиковой кислоте диоксид марганца восстанавливается до трифторида:
4MnO2 + 12HF = 4MnF3 + O2 + 6H2O.
В азотной и разбавленной серной кислотах MnO2 не растворим, лишь при длительном хранении его под раствором кислоты наблюдается постепенное выделение кислорода вследствие окисления воды. Горячая концентрированная серная кислота также реагирует с MnO2, окисляясь до кислорода:
2MnO2 + 4Н+ = 2 Mn2+ + 2Н2О + О2↑.
Реакция протекает через стадию образования Mn3+, о чем свидетельствует окрашивание раствора в фиолетовый цвет. Образованием этих ионов также объясняется и быстрое растворение MnO2 в серной кислоте при добавлении соли марганца(II):
MnO2 + Mn2+ + 4H+ = 2Mn3+ + 2H2O.
Взаимодействие диоксида MnO2 со щелочами протекает лишь в концентрированных растворах или расплавах. В зависимости от температуры реакции, соотношения реагентов, наличия или отсутствия окислителей, например, кислорода воздуха, образуются анионные оксоманаганаты, содержащие марганец в различных степенях окисления от +3 до +6. Например, при взаимодействии диоксида марганца с горячим концентрированным раствором гидроксида калия в инертной атмосфере сначала образуется зеленый раствор манганата(IV), который затем переходит в темно-синий раствор, содержащий эквимолярные количества манганата(V) и манганата(III). При проведении реакции на воздухе образуется манганат(VI) К2MnO4
2MnO2 + 4KOH + O2 = 2K2MnO4 + 2H2O,
а в токе О2 при 600-800 оС – манганат(V):
2MnO2 + 6KOH + 1/2O2 = 2K3MnO4 + 3H2O.
При атмосферном давлении воздуха реакция получения K2MnO4 начинается при 170 оС. При повышении давления до 10-19 кбар она ускоряется, и выше 19 кбар происходит взрыв. В отсутствии КОН манганат(VI) не образуется. При мольном отношении Mn:К = 4:1 на воздухе выше 450 оС образуется K2Mn8O16, при отношениях от 4:1 до 2:1 - K2Mn4O8, при еще меньшем отношении 1:3 уже при 250 оС получается K2MnO4. Для получения этой соли вместо кислорода в щелочном расплаве используют хлорат KClO3 или нитрат калия KNO3.
При добавлении диоксида марганца и перманганата калия в расплавленную щелочь образуется сине-зеленый расплав:
MnO4-+ MnO2 + 4ОН-  MnO42-+ MnO43-+ 2Н2О.
MnO42-+ MnO43-+ 2Н2О.
При высоких концентрациях щелочи равновесие сдвигается вправо: выпадают синие кристаллы манганата Na3MnO4.xH2O, а манганат(VI) остается в растворе.
При окислении расплавом нитрита натрия NaNO2 диоксид марганца сначала образует Na3MnO4 и затем Na2MnO4. При нагревании смеси порошка MnO2 с пероксидами щелочных и щелочноземельных металлов образуются манганаты(VI):
MnO2 + К2О2 = К2MnO4.
Действием еще более сильных окислителей, например, хлора в сильно щелочных растворах, MnO2 сразу переводится в перманганат.
Окисление атомов марганца в пиролюзите до высшей степени окисления реализуется также при кипячении с раствором персульфата аммония:
2MnO2 + 3(NH4)2S2O8 + 4H2O = 2HMnO4 + 3(NH4)2SO4 + 3H2SO4.
В этих реакциях диоксид марганца выступает в роли восстановителя.
Реакционная способность диокида марганца в реакциях ионного обмена намного ниже его окислительно-восстановительной активности, что является следствием его инертности – она свойственна всем ионам с конфигурацией d3. Именно поэтому, несмотря на амфотерный характер, это вещество в мягких условиях не реагирует с растворами кислот и щелочей, если при этом невозможны окислительно-восстановительные процессы. Об амфотерности диоксида марганца свидетельствует факт существования солей кислородсодержащих кислот, например, Mn(SO4)2, а также анионных манганатов(IV). Последние могут быть получены при нагревании пиролюзита с оксидами активных металлов. Например, взаимодействие c MgO приводит к Mg2MnO4 и Mg6MnO8, а c CaO – к CaMnO3, Ca2MnO4 и CaMn3O7.
Дополнение. Элемент Лекланше.
Ежегодно мировая промышленность производит около полмиллиона тонн диоксида марганца, большая часть которого идет на производство сухих электрохимических батарей. Из них наиболее обычны переносные сухие углерод-цинковые гальванические элементы, впервые предложенные французским физиком Ж. Лекланше в 1865 г.. Схему элемента можно схематично представить в виде
С│ MnO2 │≈10 % NH4Cl│Zn.
Сухой элемент Лекланше состоит из цинковой банки с вставленным в нее угольным электродом, погруженным в смесь диоксида марганца и графита. Цинковая банка помещена в крахмальную пасту, содержащую ZnCl2 и избыток твердого NH4Cl. Углерод выполняет роль положительного электрода – катода, цинк служит анодом, а диоксид марганца вводится в качестве окислителя, препятствующего выделению водорода на углероде. В настоящее время используют электролит, содержащий 8,8 % ZnCl2, 26 % NH4Cl,65,2 % H2O и небольшое количество сулемы HgCl2, играющей роль ингибитора. В ходе работы элемента происходит восстановление MnO2 и растворение цинкового анода:
Анод Zn + 2NH3 – 2e– ® Zn(NH3)22+,
Катод 2MnO2 + 2NH4+ + 2e– ® 2MnOOH + 2NH3
(сноска: Zn(NH3)22+ - усредненная формула смеси комплексных аммиакатов и основных солей цинка разного состава. Продуктами восстановления диоксида марганца, помимо MnOOH, являются MnCl2 и ZnMn2O4). Особое значение MnO2 обусловлено его высокой окислительной способностью и практической нерастворимостью в электролите, благодаря чему вторичные реакции сводятся к минимуму.
Элемент обеспечивает напряжение порядка 1,6 В. В начале процесса значение рН составляет около 5 и во время разрядки батареи возрастает до 8-9.
Для использования в элементах Лекланше пригодны только определенные типы диоксида. Непосредственно для этой цели может быть использован только природный пиролюзит высшего качества, поэтому предпочтительнее употреблять синтетический γ-MnO2 получаемый электрохимически. К преимуществам сухого элемента Лекланше относится относительное длинное время работы, к недостаткам – высокое электрическое сопротивление и непостоянство потенциала. Создание новых ячеек с катодом MnO2 и модифицированным анодом, содержащим магний вместо цинка, обеспечивает высокое рабочее напряжение.
Рис. 5.16. Внешний вид (а) и устройство (б) элемента Лекланше.
КОНЕЦ ДОПОЛНЕНИЯ
Диоксиды технеция и рения представляют собой черные порошки, нерастворимые в воде. Диоксид технеция имеет искаженную структуру рутила, а диоксид рения кристаллизуется в моноклинной (низкотемпературный α-ReO2, структурный тип МоО2) или ромбической (высокотемпературный β-ReO2) структуре. Переход α-ReO2 ® β-ReO2 происходит необратимо при 400-650 оС.
Наиболее чистые препараты получены термическим разложением пертехнетата и перрената аммония в инертной атмосфере (700-750 и 300-450 оС, соответственно) или в
вакууме:
2NH4ReO4 = 2ReO2 + N2↑ + 4H2O.
Высшие оксиды восстанавливаются металлическим рением до диоксида:
550 оС
2Re2O7 + 3Re = 7ReO2.
Выше 700 оС реакция протекает в обратном направлении. Оксид технеция(IV) при высокой температуре возгоняется, не претерпевая разложения вплоть до 1100 оС. Таким образом, термическая устойчивость диоксидов возрастает в ряду MnO2 – ReO2 – TcO2.
В отличие от пиролюзита, для оксидов технеция(IV) и рения(IV) окислительные свойства не характерны. Например, при их растворении в концентрированной соляной кислоте образуются хлорокомплексы:
ReO2 + 6HCl = H2[ReCl6] + 2H2O.
Действием концентрированной HNO3, пероксида водорода, бромной воды анионы гексахлорорената [ReCl6]2- окисляются до рениевой кислоты HReO4.
В реакциях диоксиды, как правило, выступают в роли восстановителей. Так, при нагревании на воздухе они не разлагаются, подобно MnO2, а наоборот, окисляются до высших оксидов М2О7. Диоксид технеция реагирует с галогенами, образуя оксогалогениды. Оба оксида восстанавливаются водородом до простых веществ (TcO2 при 500 оС, ReO2 – при 300 оС).
Диоксиды технеция и рения – амфотерные оксиды со слабо выраженными основными и кислотными функциями. Они нерастворимы в воде, разбавленных растворах щелочей и кислот, не проявляющих свойства окислителей. Растворение ТсО2 в кислых растворах, содержащих Н2О2 или соли CeIV, сопровождается окислением до пертехнетата.
ДОПОЛНЕНИЕ. Ренистый ангидрид
Среди металлов седьмой группы только рений образует стабильный триоксид ReO3, называемый ренистым ангидридом (Сноска: Существование оксида ТсО3 окончательно не доказано.). Это твердое красное вещество с металлическим блеском. В структуре ReO3 атомы рения расположены в центре октаэдров ReO6, каждая из вершин которых сочленена с соседними октаэдрами, образуя бесконечный трехмерный каркас (рис.5.17. Кристаллическая структура ReO3, Уэллс, т.1, стр.253).
Ренистый ангидрид обладает очень низким электрическим сопротивлением, которое, как у типичного металла, уменьшается при понижении температуры. Это объясняется наличием на атоме рения единственного валентного электрона, который делокализован по всей зоне проводимости кристалла.
Оксид рения(VI) синтезируют восстановлением рениевого ангидрида Re2O7 оксидом углерода, металлическим рением или диоксидом:
3 Re2O7 + Re = 7ReO3
Ренистый ангидрид относится к кислотным оксидам, однако, обладает низкой химической активностью: он нерастворим в воде и разбавленных растворах щелочей. Образование ренатов происходит лишь при взаимодействии его с горячей концентрированной щелочью:
ReO3 + 2NaOH = Na2ReO4 + H2O.
Длительное кипячение раствора приводит к диспропорционированию рената на перренат NaReO4 и диоксид ReO2. В расплаве щелочи или соды образуются перренат и ренит:
3ReO3 + 2Na2CO3 = 2NaReO4 + Na2ReO3 +2СО2↑,
Водными растворами окислителей (HNO3, H2O2, бромная вода) ReO3 переводится в рениевую кислоту:
2ReO3 + Н2О2 = 2НReO4.
Для рения известен также голубой пентоксид Re2O5, диспропорционирующий на Re(VII) и Re(IV), но его свойства практически не изучены.
КОНЕЦ ДОПОЛНЕНИЯ
Все три металла образуют высшие оксиды М2О7, однако, по свойствам соединение марганца существенно отличается от оксидов технеция и рения. Марганцевый ангидрид Mn2O7 является одним из наиболее сильных окислителей, в то время как для оксидов Тс2О7 и Re2O7, образующихся непосредственно при горении металлов на воздухе, окислительные свойства практически не характерны.
Марганцевый ангидрид Mn2O7 представляет собой густую летучую гигроскопичную маслянистую жидкость темно-красного цвета, в отраженном свете кажущуюся зеленой с металлическим блеском. При 5,9°C она превращается в красные кристаллы. В безводных серной и фосфорной кислотах оксид марганца(VII) образует оливково-зеленые растворы:
Mn2O7 + 3H2SO4  2MnO3+ + 3HSO4– + H3O+
2MnO3+ + 3HSO4– + H3O+
Вещество очень неустойчиво – оно разлагается со взрывом при сотрясении, в присутствии даже следовых количеств органических веществ, а также при нагревании выше 55 °C. Горазно более безопасны в обращении его растворы в четыреххлористом углероде (M. Tromel, M. Russ, Angew. Chem., Int. Ed. Engl., 1987, 26, 1007). Оксид марганца(VII), являющийся ангидридом марганцевой кислоты, получают действием концентрированной серной кислоты на перманганаты щелочных металлов:
2KMnO4 + 2H2SO4 = 2KHSO4 + Mn2O7↓ + H2O.
Марганцевый ангидрид один из немногих оксидов металлов, имеющих молекулярное строение. В газообразном, жидком и твердом состоянии он состоит из молекул Mn2O7, представляющих собой два тетраэдра [MnO4], соединенных общей вершиной. В кристаллическом веществе угол Mn-O-Mn составляет 120,7° (A. Simon, R. Dronskowski, B. Krebs, B. Hettich, Angew.Chem., Int. Ed. Engl., 1987, 26, 139) (Рис.5.18. Строение высших оксидов (а) марганца, (б) технеция, (в) рения). Кристаллы, необходимые для определение кристаллической структуры этого вещества, были выращены в тонком стеклянном капилляре, содержащем несколько капель марганцевого ангидрида и сразу помещенном в дифрактометр.
При растворении в воде оксид марганца(VII) Mn2O7 образует темно-фиолетовый раствор марганцевой кислоты НМnO4. Реакция протекает настолько быстро, что над сосудом часто возникает красно-фиолетовый туман, состоящий из капелек раствора НМnO4 и постепенно превращающийся в коричневые частицы пиролюзита .
Марганцевый ангидрид термодинамически нестабилен: он постепенно теряет кислород даже при 0°C. Медленное разложение приводит к образованию γ-MnO2, а при детонации кристаллизуется α-Mn2O3:
Mn2O7 = Mn2O3 + 2O2↑ ΔH = - 231,3 кДж/моль,
Mn2O7 = 2MnO2 + 3/2O2↑ ΔH = - 307,1 кДж/моль.
Марганцевый ангидрид окисляет большинство кислородсодержащих органических соединений, во многих случаях происходит воспламенение. На этом основан один из способов зажигания спиртовки в отсутствие спичек. Для этого в фарфоровой чашке растирают несколько кристалликов перманганата калия и приливают к ним две-три капли концентрированной серной кислоты. В полученную маслянистую жидкость, содержащую марганцевый ангидрид, опускают стеклянную палочку, которой затем прикасаются к фитилю спиртовки.
Высшие оксиды технеция и рения представляют собой желтые (Сноска: красноватый оттенок кристаллов Тс2О7 свидетельствует о наличии примеси НТсО4) кристаллические порошки, используемые для очистки и промышленного производства металлов. При нагревании они плавятся без разложения, 120 °C (Тс2О7) и 300 оС (Re2O7), частично переходя в газовую фазу, поскольку обладают высокой летучестью. Высшие оксиды технеция и рения получают окислением металлов, низших оксидов и сульфидов кислородом:
2MS2 + 7,5O2 = M2O7 + 4SO2↑,
термическим разложением пертехнетата и перрената аммония:
2NH4MO4 = M2O7 + 2NH3 + H2O.
В газовой фазе эти оксиды стабильны и мономерны, их молекулы состоят из двух сочлененных вершинами тетраэдров МО4. В твердом состоянии такая структура с линейными мостиками сохраняется только у Тс2О7, однако, в отличие от марганцевого ангидрида, угол Тс-О-Тс равен 180° (рис.5.18 б) (B. Krebs, Z. Anorg. Allg. Chem., 1971, 380, 146). Кристаллы высшего оксида рения имеют полимерное строение и состоят из двойных слоев, образованных сильно искаженными октаэдрами ReO6 и правильными тетераэдрами ReO4, соединенными общими вершинами в тетрамерные циклы (рис.5.18 в). Между отдельными слоями существует лишь слабое ориентационное взаимодействие (B. Krebs, A. Muller, H. Beyer, Inorg. Chem., 1969, 8, 436). В каждом октаэдре ReO6 три связи Re-O заметно длиннее трех других и легко разрушаются при нагревании. Этим и объясняется легкая летучесть рениевого ангидрида.
Высшие оксиды технеция и рения, подобно марганцевому ангидриду, чрезвычайно гигроскопичны во влажном воздухе и быстро поглощают воду, превращаясь в технециевую НТсО4 и рениевую НReO4 кислоты, например:
Тс2О7(тв) + Н2О(ж) = 2НТсО4(тв) ΔН° = –1,800 кДж/моль, ΔG° = –6,828 кДж/моль.
В отличие от Mn2О7, они являются слабыми окислителями, при комнатной температуре, не способными окислить большинство органических веществ.
Они взаимодействуют со спиртами, пиридином, тетрагидрофураном с образованием комплексных сольватов М2О7.2L (L-молекула орагнического вещества). Даже взаимодействие с амидом калия в жиком аммиаке не сопровождается окислительно-восстановительным процессом, а приводит к образованию нитридорената(VII):
Re2O7 + 3KNH2 = K2ReO3N + KReO4 + 2NH3.
Оксид Тс2О7 является более сильным окислителем, чем Re2O7. Он восстанавливается парами органических веществ. Таким образом, окислительная активность высших оксидов убывает вниз по группе.
Водородом оба оксида восстанавливаются до металлов. При взаимодействии с монооксидом углерода при 300 атм. и 220 оС технеций образует летучий карбонил Тс2(СО)10, а рений – низшие оксиды ReOх (х < 2), свойства которых практически не изучены.
Дата добавления: 2016-01-03; просмотров: 4369;
