ЛЕКЦИЯ №6. Поверхностные явления.
Любые гетерогенные процессы (разложение, испарение и т.д.) проходят на поверхности раздела фаз. Состояние вещества у поверхности раздела двух фаз отличается от состояния этого же вещества внутри этих фаз.
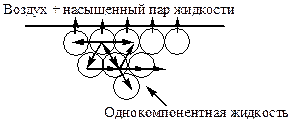
Молекула жидкости, находящаяся в объеме, испытывает в среднем одинаковое по всем направлениям притяжение со стороны окружающих ее молекул. Силы молекулярного притяжения, действующие по всем направлениям, взаимноуравновешены, и для перемещения молекулы внутри жидкости не требуется затрачивать работу. Молекулы поверхностного слоя оказываются в иных условиях. Т.к. молекулы пара находятся от них на большем расстоянии, чем соседние молекулы жидкости, то сила притяжения, направленная в сторону воздуха, во много раз меньше силы притяжения, действующей в противоположную сторону. Вследствие этого молекулы поверхностного слоя обладают большей энергией, чем молекулы внутри жидкости. Поэтому весь поверхностный слой имеет избыточную поверхностную энергию Е. Для перемещения одной молекулы жидкости из объема на поверхность необходимо затратить работу, связанную с преодолением сил межмолекулярного взаимодействия.
Работа, затрачиваемая на образование 1-го кв. см поверхности раздела фаз, или эквивалентная ей свободная энергия, отнесенная к 1 см2 поверхности, называется поверхностным натяжением σ:
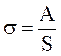
где А – работа обратимого изотермического процесса образования новой поверхности площадью S.
В форме работы можно реализовать не всю внутреннюю энергию тела, а только часть, которую и называют свободной энергией системы.
Если σ - избыток свободной энергии на одном кв. см, то свободная поверхностная энергия гетерогенной системы:
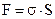
Чем больше площадь раздела фаз (S), тем больше свободная поверхностная энергия, сконцентрированная на этой поверхности. Следовательно, все дисперсные системы, особенно коллоидные, обладают большим запасом свободной энергии.
Однако, состояние с избытком энергии неустойчиво. Поэтому в гетерогенных системах самопроизвольно протекают процессы, сопровождающиеся уменьшением свободной энергии. Процессы, которые приводят к изменению запаса энергии молекул, находящихся на поверхности фазы, называются поверхностными явлениями.
Примером такого самопроизвольно протекающего процесса является сорбция. Сорбция – это процесс сгущения растворенного или парообразного вещества на поверхности твердого тела или жидкости. Сорбция, происходящая только на поверхности тела, называется поверхностным поглощением, или адсорбцией, а процесс поглощения объемом, называется абсорбцией. Поглощающее вещество называется сорбентом, а поглощаемое – сорбтив или сорбат.
Различают два вида адсорбции: физическую и хемосорбцию. В случае физической адсорбции молекулы сорбтива связаны с поверхностными атомами сорбента слабыми ван-дер-ваальсовыми силами (дисперсионными, индукционными и ориентационными). Физическая адсорбция – процесс обратимый, т.е. молекулы сорбтива могут переходить обратно в объем (десорбция).
Хемосорбция обусловлена проявлением химических, валентных сил между адсорбированными молекулами и атомами поверхности адсорбента.
Особенно большое значение имеет адсорбция из газовой фазы на поверхности твердых веществ, которая зависит от давления, температуры и природы газа.
Дата добавления: 2015-10-19; просмотров: 1469;
