COOH COOH
Глутаминоая кислота a-кетоглутаровая кислота
в) Трансаминирование (переаминирование) - реакция между аминокислотами и a-кетокислотами. В ходе этой реакции ее участники обмениваются функциональными группами, в результате чего аминокислота превращается в a-кетокислоту, а кетокислота становится аминокислотой:
 R1 R2 R1 R2
R1 R2 R1 R2






 H-C-NH2+C = O ¾¾® C =O+H-C-NH2
H-C-NH2+C = O ¾¾® C =O+H-C-NH2
 COOH COOH COOH COOH
COOH COOH COOH COOH
Трансаминированию подвергаются все аминокислоты. В этой реакции участвует кофермент - фосфопиридоксаль, для образования которого необходим витамин В6 - пиридоксин.
Трансаминирование - это главное превращение аминокислот в организме, так как его скорость значительно выше, чем у реакций декарбоксилирования и дезаминирования.
Трансаминирование выполняет две основные функции:
а) За счет трансаминирования одни аминокислоты могут превращаться в другие. При этом общее количество аминокислот не меняется, но изменяется соотношение между ними. С пищей в организм поступают чужеродные белки, у которых аминокислоты находятся в иных пропорциях по сравнению с белками организма. Путем трансаминирования происходит корректировка аминокислотного состава организма.
б) Трансаминирование является составной частью косвенного (непрямого)дезаминирования аминокислот - процесса, с которого начинается распад большинства аминокислот. На первой стадии этого процесса аминокислоты вступают в реакцию трансаминирования с a-кетоглутаровой кислотой (a-кетокислота). Аминокислоты при этом превращаются в a-кетокислоты, а a-кетоглутаровая кислота переходит в глутаминовую кислоту (аминокислота). На второй стадии появившаяся глутаминовая кислота подвергается дезаминированию, от нее отщепляется NH3 и снова образуется a-кетоглутаровая кислота.
Схема косвенного дезаминирования: 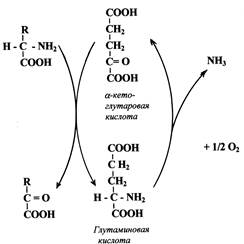
|
Итоговое уравнение косвенного дезаминирования совпадает с уравнением прямого дезаминирования:
R R




 H-C-NH2 + 1/2 O2 C=O
H-C-NH2 + 1/2 O2 C=O
COOH - NH3 COOH
Однако у косвенного дезаминирования скорость значительно выше, чем у прямого, что обусловлено высокой активность ферментов, катализирующих обе стадии этого процесса.
Отсюда вытекает, что реакцией, с которой начинается распад аминокислот в организме, является трансаминирование.
Образовавшиеся a-кетокислоты далее подвергаются глубокому распаду и превращаются в конечные продукты CO2 и H2O. Для каждой из 20 кетокислот (их образуется столько же, сколько имеется видов аминокислот) имеются свои специфические пути распада. Однако при распаде некоторых аминокислот в качестве промежуточного продукта образуется пировиноградная кислота, из которой возможен синтез глюкозы. Поэтому аминокислоты, из которых возникают такие кетокислоты, получили название «глюкогенные». Другие же кетокислоты при своем распаде не образуют пирувата. Промежуточным продуктом у них является ацетил-кофермент А, из которого невозможно получить глюкозу, но зато могут синтезироваться кетоновые тела. Аминокислоты, соответствующие таким кетокислотам, называются «кетогенные».
Второй продукт косвенного дезаминирования аминокислот - аммиак. Для организма аммиак является высоко токсичным. Поэтому в организме имеются молекулярные механизмы его обезвреживания.
9.6. Обезвреживание аммиака.
По мере образования NH3 связывается во всех тканях с глутаминовой кислотой с образованием глутамина:
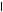 COOH CONH2
COOH CONH2
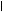
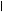
 CH2 СH2
CH2 СH2
 СH2 +NH3 + АТФ CH2
СH2 +NH3 + АТФ CH2


 H-C-NH2 - АДФ H-C-NH2
H-C-NH2 - АДФ H-C-NH2
 COOH - H3PO4 COOH
COOH - H3PO4 COOH
Глутаминовая Глутамин
кислота
Это временное обезвреживание аммиака. С током крови глутамин поступает в печень, где распадается опять на глутаминовую кислоту и NH3.Образовавшаяся глутаминовая кислота с кровью снова поступает в органы для обезвреживания новых порций аммиака. Освободившийся аммиак, а также углекислый газ в печени используются для синтеза мочевины.
Синтез мочевины - циклический, многостадийный процесс, потребляющий большое количество энергии. В синтезе мочевины очень важное участие принимает аминокислота орнитин. Эта аминокислота не входит в состав белков. Образуется орнитин из другой аминокислоты – аргинина, которая присутствует в белках. В связи с важной ролью орнитина синтез мочевины получил название «орнитиновый цикл».
В процессе синтеза к орнитину присоединяются две молекулы аммиака и молекула углекислого газа, и орнитин превращается в аргинин, от которого сразу же отщепляется мочевина, и вновь образуется орнитин:
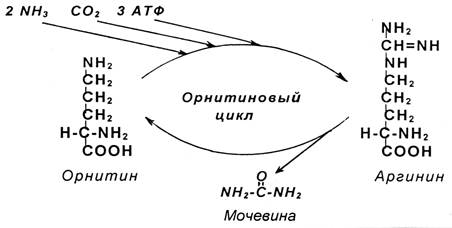 |
Наряду с орнитином и аргинином в образовании мочевины еще участвуют аминокислоты: глутамин и аспарагиновая кислота. Глутамин является поставщиком аммиака, а аспарагиновая кислота его переносчиком.
Синтез мочевины - это окончательное обезвреживаниеаммиака. Из печени с кровью мочевина поступает в почки и выделяется с мочой. В сутки образуется 20-35 г мочевины. Выделение мочевины с мочой характеризует скорость распада белков в организме.
В обобщенном виде обмен белков можно отразить следующей схемой:
Дата добавления: 2015-10-19; просмотров: 1467;
