Пример 6.
При 25 0С и давлении93 кПа. (745 мм Т. Ст.) некоторое количество газа занимает объем 152 мл. Найти, какой объем займет это же количество газа при 0 0С и давлении 101,33 кПа.
Решение.
Подставляя данные задачи в последнее уравнение, получаем:
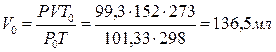
КОНТРОЛЬНЫЕ ЗАДАНИЯ
1. 0,075 г металла вытесняет из раствора соли никеля 0,183 г никеля, а из раствора кислоты – 70 мл водорода, измеренного при нормальных условиях. Определите молярные массы эквивалентов металла и никеля. Ответ: 29,35 г/моль
2. При сгорании трёхвалентного металла в количестве 23,48 г было получено 44,40 г его оксида. Какой металл был сожжен? Определите массу оксида. Ответ: Al2O3 ; 17 г/моль.
3. Определите молярные массы эквивалентов кислот и гидроксидов в реакциях:
H2SO4 + 2NaOH = Na2SO4 + 2H2O Ответ: 49 г/моль
2H3PO4 + Ca(OH)2 = Ca(H2PO4)2 + 2H2O Ответ: 98 г/моль
Al(OH)3 + 3NaCl = AlCl3 + 3NaOH Ответ: = 26 г/моль
Zn(OH)2 + NaCl = ZnOHCl + NaOH Ответ: 99,4 г/моль
4. На реакцию с 13,61 г дигидрофосфата калия израсходовано 5,61 г гидроксида калия. Вычислите молярную массу эквивалента дигидрофосфата калия и напишите уравнения реакции. Ответ: 136,1 г/моль
5. Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислите эквивалентную массу металла (МЭ(Ме)). Ответ: 15 г/моль.
6. В какой массе Са(ОН)2 содержится столько же эквивалентов, сколько в 312г А1(ОН)3? Ответ: 444г.
7. Вычислите абсолютную массу молекулы серной кислоты в граммах. Ответ: 1,63* 10-22
8. На восстановление 3,6 г оксида двухвалентного металла израсходовано 1,7 л водорода (н.у.). Вычислить молярные массы эквивалента оксида и металла. Ответ: 15,72 г.
9. Объемное содержание углекислого газа в воздухе составляет 0,03% (н.у.). Найти количество (моль) и массу (г) СО2, содержащегося в 0,5 м3 воздуха. Ответ: 0,295 г.
10. Масса колбы вместимостью 750 мл, наполненной при 27°С кислородом, равна 83,3 г. Масса пустой колбы составляет 82,1 г. Определить давление кислорода в колбе. Ответ: 124,65 кПа.
11. При сгорании 5,00 г трехвалентного металла образовалось 9,45 г его оксида. Определите молярную массу эквивалента этого металла и назовите металл. Ответ: 27 г.
12. 0,978 г щелочного металла реагирует с 0,200 г кислорода и с 3,17 г галогена. Определите эквивалент галогена и назовите его. Ответ: галоген – I.
13. Чему равен эквивалент щелочноземельного металла и его оксида, если известно, что 0,608 г металла вытесняют из раствора соляной кислоты 0,560 л водорода (н.у.)? Определите металл. Ответ: металл – Mg.
14. 0,200 г двухвалентного металла вытеснили 197 см3 водорода, который был собран под водой и измерен при 20ºС и 780 мм Hg. Давление насыщенных паров воды при этих условиях составляет 17,4 мм Hg. Определите, какой это металл. Ответ: металл – Mg.
15. 3,16 г перманганата калия взаимодействуют с концентрированной соляной кислотой. Образующийся хлор пропустили в раствор иодида калия. Сколько граммов иода выделилось, если общий выход реакций составил 80 %? Ответ: 10,2 г.
16. Определите эквивалент и эквивалентные массы элементов в соединениях с водородом: H2O, HCl, PH3. Ответ: 8 г/моль, 35,5 г/моль, 10,3 г/моль.
17. Определите эквивалентные массы следующих соединений: CO2, H2SO4, Cu(OH)2, MgCl2. Ответ: 11 г/моль, 49 г/моль, 49 г/моль, 47,5 г/моль.
18. На нейтрализацию кислоты массой 2,18 г израсходовано KOH массой 2,49 г. Определите эквивалентную массу кислоты. Ответ: 49 г/моль.
19. Определите массу металла, вступившего в реакцию с кислотой, если при этом выделился водород объёмом 260 мл при нормальных условиях. Эквивалентная масса металла mэ(Ме) = 9 г/моль. Ответ: 0,2 г.
20. Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислите эквивалентную массу металла. Ответ: 15 г/моль.
21. При взаимодействии магния с кислородом образуется оксид магния. Определите массу магния, необходимую для реакции с кислородом массой 64 г, а также массу образующегося при этом оксида. Ответ: m (Мg) = 96 г, m (MgO) = 160г.
22. Чему равны массы цинка и серы, необходимые для получения сульфида цинка массой 485 г? Ответ: m (MgO) = 325 г, m (S) = 160 г.
23. Определите массу хлорида калия, образующегося при взаимодействии хлористого водорода массой 219 г с раствором, содержащим гидроксид калия массой 224 г. Ответ: 298 г.
24. При 25°С и давлении 745 мм Т. Ст. некоторое количество газа занимает объем 152 мл. Вычислить, какой объем займет это же количество газа при нормальных условиях. Ответ: 136,5 мл.
25. Чему равны значения а) относительной плотности хлора по воздуху, б) массы 1 л хлора (при н.у.), в) объема 1 л хлора (при н.у.). Ответ: а) 2,45; б) 3,17 г; в) 0,3 л.
26. При растворении металла массой 0,0548 г в избытке раствора кислоты выделялся водород объемом 50,4 мл (н.у.). Вычислите значение молярной массы эквивалента металла. Ответ: 12,17 г/моль.
27. Вычислить эквивалент и молярную массу эквивалента ортофосфорной кислоты в реакциях: а) с магнием, б) с гидроксидом калия, если при этом образуется кислая соль K2HPO4. Ответ: а) 32,67 г/моль; б) 49 г/моль.
28. При окислении металла массой 8,43 г образовался оксид массой 9,63 г. Вычислите значения молярных масс эквивалентов металла и его оксида. Ответ: 64,2 г/экв.
29. Вычислите значения относительной атомной массы и молярной массы эквивалента некоторого элемента, зная, что массовая доля данного элемента в его оксиде составляет 46,74 % и что на один атом его в оксиде приходится два атома кислорода. Ответ: 28,08 г/моль.
30. Масса 0,327 ·10-3 м3 газа, при 13 оС и давлении 1,04 ·105 Па равна 0,828 ·10-3 кг. Вычислить молярную массу газа. Ответ: 57,8 * 10-3 кг/моль.
Дата добавления: 2015-09-29; просмотров: 1973;
