Электрокинетические свойства коллоидных систем
Явления относительного движения фаз вдоль поверхности раздела, обусловленные внешним электрическим полем или приводящие к возникновению электрического поля, называются электрокинетическими явлениями.
Движение под действием внешнего электрического поля свободных частиц дисперсной фазы в дисперсионной среде называется электрофорезом, а движение жидкости относительно неподвижной твердой фазы называется электроосмосом.
Возникновение электрического поля при механическом движении свободных частиц дисперсной фазы в дисперсионной среде называется потенциалом седиментации (эффект Дорна), а при движении жидкости относительно неподвижной твердой фазы называется потенциалом протекания (течения).
Изучение этих явлений имеет большое и разностороннее значение для теории процессов, происходящих в поверхностном слое (в частности, в вопросах устойчивости дисперсных систем), и широко используется при решении различных практических задач.
В основе этих явлений лежит наличие на поверхности раздела фаз двойного электрического слоя из ионов, возникающего либо в результате избирательной адсорбции одного из ионов электролита, находящегося в растворе, либо за счет ионизации поверхностных молекул веществ.
Рассмотрим образование двойного электрического слоя на поверхности частиц дисперсной фазы коллоидного раствора, называемых мицеллами.Внастоящее время нет возможности учесть влияние на строение мицеллы всех процессов, обусловленных сложными ионно-молекулярными взаимодействиями на поверхности раздела двух фаз в растворе. Если исключить влияние растворителя, в котором образуется коллоидная система, то упрощенные схемы мицеллы золя, например, иодида серебра, полученные при сливании сильно разбавленных растворов AgNO3 и KI, можно представить следующим образом (рис. 7.1).
AgNO3 + KI = AgI¯ + KNO3
Галогениды серебра нерастворимы в воде и при смешении растворов AgNO3 и KI должны выпадать в осадок. Однако, если смешивать разбавленные растворы и брать один из реагентов в избытке, то AgI не выпадает в осадок, а образуется коллоидный раствор. Образующиеся при этом кристаллы AgI настолько маленькие, что тепловые силы (силы броуновского движения) больше силы тяжести, и поэтому они не оседают. Но они уже имеют реальную поверхность раздела фаз, которая обладает свободной поверхностной энергией, так как на ее создание затрачена работа (G(s) = s S). При избытке раствора KI в растворе присутствуют ионы К+, NO  и I-, которые могут адсорбироваться на поверхности кристалликов AgI, так как это приведет к уменьшению свободной поверхностной энергии за счет уменьшения s. По правилу Панета – Фаянсана поверхности твердого вещества предпочтительно адсорбируются ионы, способные достраивать его кристаллическую решетку.
и I-, которые могут адсорбироваться на поверхности кристалликов AgI, так как это приведет к уменьшению свободной поверхностной энергии за счет уменьшения s. По правилу Панета – Фаянсана поверхности твердого вещества предпочтительно адсорбируются ионы, способные достраивать его кристаллическую решетку.
Таким образом, в данном примере на поверхности AgI будут адсорбироваться ионы I-. В результате этого процесса кристалл AgI, называемый ядром мицеллы, заряжается отрицательно. Ионы, создающие этот заряд, называются потенциалопределяющими.Отрицательно заряженная частица (агрегат) начнет притягивать из раствора ионы с противоположным знаком К+ (противоионы); образуется двойной электрический слой. Большая часть противоионов очень прочно
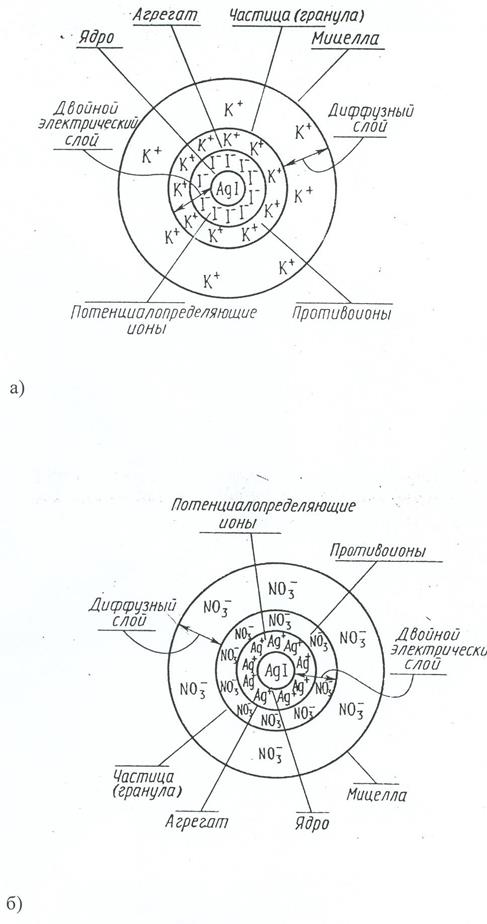
Рис. 7.1. Схема строения мицеллы AgI при избытке а) KI, б) AgNO3
притягиваются к агрегату, образуя адсорбционный слой противоионов. Агрегат вместе с адсорбционным слоем называют частицейили гранулой.Часть противоионов не помещается в адсорбционном слое из-за теплового движения, они располагаются на более далеком расстоянии от ядра, образуя так называемый диффузный слойпротивоионов. Толщина диффузного слоя во много раз больше толщины адсорбционного слоя, он менее плотный и более неустойчивый.
Состав мицеллы может быть изображен схематически следующим образом. При избытке KI золь иодида серебра может быть представлен формулой
гранула



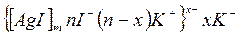


 ядро
ядро

мицелла
Потенциалопределяющие ионы nI- придают грануле отрицательный заряд, так как n>(n-x).
При избытке AgNO3 гранулы имеют положительный заряд, поскольку потенциалопределяющими ионами являются Ag+:
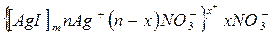
Таким образом, на поверхности раздела фаз образуется двойной электрический слой, строение которого представлено на рис. 7.2. Возникающий при этом термодинамический потенциал (j) резко падает в адсорбционном слое и постепенно до нуля в диффузном слое. Та часть всего потенциала, которая приходится на диффузный слой, называется электрокинетическим потенциаломили z - потенциалом (дзета – потенциалом). Т.е. разность потенциалов между подвижной (диффузной) и неподвижной (адсорбционной) частями двойного электрического слоя называется электрокинетическим или z - потенциалом.
Если коллоидную частицу поместить в постоянное электрическое поле, то приложенной разности потенциалов хватит, чтобы сорвать неплотный диффузный слой мицеллы. Небольшое количество ионов, составляющих диффузный слой, пойдет к противоположно заряженному электроду, но их трудно определить количественно. Заряженная гранула (мицелла без диффузного слоя) двигается к другому электроду, где ее легко обнаружить из-за большого количества. Создается представление об односторонности процесса электрофореза.
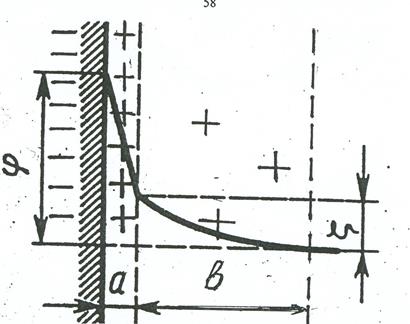
Рис. 7.2. Схема двойного электрического слоя. а – адсорбционный слой, в – диффузный слой, z - электрокинетический потенциал.
Дата добавления: 2015-09-28; просмотров: 1131;
