Борьба с коррозией. Методы защиты материалов и изделий от разрушений
Коррозионная стойкость - способность материала сопротивляться воздействию агрессивной среды. Коррозионные повреждения материалов и изделий приводят к поломке конструкций, оборудования, причиняют огромный ущерб и убытки в промышленности и быту. В настоящее время проблемы коррозии материалов не уменьшаются, а наоборот еще более обостряются. Поэтому вопросы борьбы с коррозией, темы защиты материалов от разрушений встают перед людьми довольно остро. Однако полностью ликвидировать коррозионные процессы нельзя, можно только замедлить или предотвратить ее развитие. Для предупреждения разрушений человеком используется комплекс противокоррозионных мероприятий, заключающийся в защите поверхностей материалов, изделий и оборудования различными методами.
Наиболее распространенными являются: нанесение разнообразных защитных покрытий на металлические поверхности; изменение условий среды; увеличение коррозионной стабильности основного материала, применение ингибиторов коррозии, электрохимическая защита и создание коррозионностойких материалов.
Противокоррозионные покрытия. Покрытия классифицируют по назначению, природе, методу нанесения и времени эксплуатации.
По назначению покрытия бывают защитные, декоративные и специальные. По природе компонентов их подразделяют на неорганические, органические и комбинированные. По методу нанесения они являются физическими, химическими и электрохимическими. По времени эксплуатации различают временные, постоянные и периодически возобновляемые покрытия.
При нанесении защитных покрытий на поверхности материалов и изделий преследуется цель уменьшения или полного предотвращения их контакта с агрессивной средой. Покрытия не только выполняют функцию защиты, но и придают изделиям красивый внешний вид. Наносимые пленки обладают большей устойчивостью к коррозии, чем защищаемые ими изделия, а также являются сплошными, непористыми, имеют хорошую сцепляемость с основой.
Неорганические покрытия бывают металлические (цинковые, кадмиевые, хромовые, никелевые, медные и др.) и неметаллические или керамические (оксиды металлов, нитриды, карбиды, бориды, силициды, неорганические эмали, соединения хрома, фосфора и др.).
К органическим покрытиям относятся лаки, краски, смазки, битумы, цементы, эмали, пластмассы, смолы, резина и др.
Металлические защитные покрытия. Металлические покрытия в свою очередь подразделяют по способам их нанесения на: гальванические; погруженные в расплав металла; плакированные; диффузионные и изотермически напыленные. Все эти методы объединяют под названием металлизация.
Гальванические (электролитические) покрытия получают осаждением металлов при электролизе водных растворов и расплавов соответствующих солей. Процесс проводят под действием постоянного тока определенной плотности при индивидуальной температуре в различных электролитах. Под действием ЭДС молекулы солей в водных растворах и расплавах диссоциируют на ионы. При этом катионы (положительно заряженные) движутся к катоду и осаждаются на нем, а анионы (заряд отрицательный) – к аноду, где происходит их рекомбинация и переход металла электрода в виде положительных ионов в раствор или расплав. Предварительной операцией является очистка поверхности от загрязнений. В данном случае обработку производят тремя способами: механическим (шлифовка, песко- и дробеструйная очистка), химическим и электрохимическим (обезжиривание, травление и электрохимическое полирование). Хранение подготовленных изделий до покрытия не более 4 - 6 часов.
По разности потенциалов основного и покрывающего металлов покрытия бывают анодные и катодные. Если покрывающий металл имеет по сравнению с основным металлическим материалом более электроотрицательный потенциал, то при этом происходит образование гальванической пары, в которой металлическое покрытие является анодом, и называется анодным. В процессе эксплуатации оно повреждается и предупреждает разрушение основного металла. По отношению к железу анодными покрытиями бывают алюминий, марганец, хром, цинк и др. Эти металлы в электрохимическом ряду (ряду напряжений) располагаются перед железом, т. е. левее его. Они являются более активными металлами.
Металлическое покрытие, имеющее более электроположительный потенциал, чем основной металл, называют катодным. В этом случае в формирующейся гальванической паре анодом становится основной металл материала или детали, а осажденное металлическое покрытие – катодом. При попадании агрессивной среды через образующие дефекты в покрытии первым разрушается основной металл. Катодными покрытиями относительно железа могут служить кадмий, никель, олово, свинец, медь, серебро и др. Данные металлы в ряду напряжений помещаются за железом, т. е правее его, а некоторые даже за водородом.
Для защиты металлических деталей применяют цинкование, кадмирование, никелирование, хромирование, серебрение и лужение. Изделия из стали чаще всего защищают цинком, кадмием, никелем, оловом и хромом, а изделия из медных сплавов - никелем, серебром и оловом. Корпуса микросхем из ковара покрывают гальваническим никелем, который может служить защитным слоем и подслоем для последующего нанесения золотого электролитического покрытия.
Например, кровельное железо предохраняют от коррозии цинком (цинкование) и называют оцинкованным. Цинк, хотя и является более активным металлом, чем железо, покрыт снаружи защитной окисной пленкой. При ее повреждении возникает гальваническая пара железо-цинк. Катодом (положительным) служит железо (Е 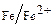 = –0,44), анодом (отрицательным) - цинк (Е
= –0,44), анодом (отрицательным) - цинк (Е 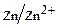 = –0,76). Электроны переходят от цинка к железу, цинк растворяется, но железо остается защищенным до тех пор, пока слой цинка не разрушится до конца. Крыши, изготовленные из оцинкованного железа с толщиной покрытия 0,03 мм с двух сторон, имеют срок службы около восьми лет. Такое же покрытие в городской и промышленной атмосфере, содержащей оксиды серы и под действием влаги превращающееся в серную кислоту, служит в два раза меньше, т. е. четыре года.
= –0,76). Электроны переходят от цинка к железу, цинк растворяется, но железо остается защищенным до тех пор, пока слой цинка не разрушится до конца. Крыши, изготовленные из оцинкованного железа с толщиной покрытия 0,03 мм с двух сторон, имеют срок службы около восьми лет. Такое же покрытие в городской и промышленной атмосфере, содержащей оксиды серы и под действием влаги превращающееся в серную кислоту, служит в два раза меньше, т. е. четыре года.
Гальваническое никелирование на стальных поверхностях (детали автомобилей, медицинских приборов, бытовых изделий и др.) выполняют чаще всего в декоративных целях. В данном случае из-за высокой пористости никелевого покрытия под него наносят подслой из меди, который практически не имеет пор. Такое покрытие называется многослойным.
Издавна известным и широко распространенным также является покрытие железа оловом (лужение). Такое железо называют белой жестью. Это пример катодного покрытия. В процессе его повреждения возникает гальваническая пара железо-олово, в которой коррозии подвергается железо (Е 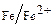 = –0,44) как анод, а олово (Е
= –0,44) как анод, а олово (Е 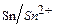 = –0,14) сохраняется.
= –0,14) сохраняется.
Покрытие металлов оловом было разработано человеком в бронзовом веке (3 - 1 век до н. э.). Олово и продукты его химического взаимодействия со средой не ядовиты и для человеческого организма безвредны. Поэтому оловянные материалы широко применялись для производства различной посуды. Так в XII веке оловянные ложки, чашки, тарелки и т. д. начали изготавливать в рудных горах Богемии. В XV веке уже помимо Германии, посуда из олова широко использовалась в таких странах как Австрия, Голландия, Англия и Франция. В старые времена более широко осуществляли лужение медной и латунной посуды: кувшинов, самоваров, тазов и др. предметов домашней утвари.
Из луженого железа до сих пор производят тару (банки) для хранения мясных, рыбных и др. консервов. Впервые использование металлических банок в производстве пищевых консервов было осуществлено в 19 веке, а именно во Франции в 1810 году. В настоящее время на смену белой жести в этой роли все шире выступает алюминиевая фольга.
Во всех остальных способах металлизации получаются более толстые металлического покрытия, чем электролитические.
Погружением металлических материалов или деталей в расплавленный металл называют горячим покрытием, а с помощью пистолета-распылителя - горячим распылением.
Горячее покрытие выполняют только на металлических деталях. Методом погружения деталей в расплав чаще всего наносятся покрытия из цинка и олова. Покрытие оловом осуществляют при выполнении монтажных работ в производстве радиоэлектронной аппаратуры для получения поверхностного электропроводного слоя и защиты от коррозии.
Горячее распыление используют для получения металлических покрытий на металле, керамике, пластмассе, стекле, конденсаторной бумаге, тончайшей ткани, полистирольной пленке и других материалах с низкой нагревостойкостью.
Нагретый в пистолете металл распыляют на поверхность детали нейтральным азотом или углекислым газом. Защитный слой (d = 10 - 50 мкм) имеет диффузионное сцепление с основой. Недостатки метода - трудность достижения равномерной толщины покрытия, а также большой расход металла, который например, при использовании цинка для слоя толщиной 25 мкм составляет до 600 г/м2.
Диффузионный способ защиты основан на изменении химического и фазового состава поверхностного слоя металла при вхождении в него подходящих элементов, которые обеспечивают коррозионную стойкость. Стали от атмосферной коррозии сохраняют цинкованием, алитирование применяют для защиты от окисления при повышенных температурах. Кремниевые покрытия (силицирование) используют для предохранения жаростойких металлов, борирование - для повышения износостойкости и прочности.
Плакирование металлов употребляют для изготовления биметаллических листов типа сталь-никель, сталь-титан, сталь-медь, сталь-алюминий. Его проводят методами совместного горячего пластического деформирования, электродуговой и электрошлаковой наплавкой, сваркой взрывом.
Напыляемые покрытия получают газотермическим, плазменным, детонационным и вакуумным способами. При этомметалл распыляется в жидкой фазе в виде капель и осаждается на покрываемую поверхность. Метод прост, позволяет получать слои любой толщины с хорошим сцеплением с основным металлом.
Вакуумные покрытия получают при нанесении тонкого слоя любого металла на поверхность металлических и неметаллических деталей в вакууме. При данном способе материал покрытия нагревают до состояния пара, и паровой поток конденсируется на поверхности изделия. При этом используют катодное распыление или вакуумное испарение.
Катодное распыление проводят в вакуумных установках. В качестве анода используют металлическую пластину, на которую закрепляют деталь. Катодом служит пластинка металла, которым необходимо покрыть данное изделие. Под действием разности потенциалов частицы с катода переносятся на анод и осаждаются на деталь. Процесс выполняют при высоком напряжении (примерно 10 - 30 кВ) в течение нескольких часов.
Вакуумное испарение также осуществляют в вакуумных установках, в которых роль испарителя выполняет вольфрамовая спираль, покрытая металлом, подлежащим испарению. Изделие закрепляют на держателе на определенном расстоянии от испарителя. Спираль нагревают в вакууме до температуры, при которой наступает интенсивное испарение и осаждение металла на деталь. Данный способ находит более широкое применение, так как не имеет недостатков катодного распыления.
Методы напыления позволяют защищать сборные конструкции. Однако расход металла при этом очень значительный, а покрытие получается пористым и для обеспечения противокоррозионной защиты требуется дополнительное уплотнение термопластическими смолами или другими полимерными материалами. При восстановлении изношенных деталей машин пористость является весьма ценной, так как служит носителем смазочных материалов.
Химический метод применяют для получения покрытий погружением детали в специальные растворы, содержащие соединения покрывающего металла и восстановителя, без электрического тока. В качестве восстановителей используют гипофосфит и боргидрид натрия, формальдегид, гидразин. Происходящие процессы являются каталитическими или автокаталитическими. Роль катализатора в первых из них выполняет поверхность изделия. Поэтому выделение металла происходит именно на ней, а не в объеме раствора. В автокаталитических процессах катализатором является металл, наносимый на защищаемую поверхность. Метод основан на восстановлении катионов осаждаемого металла в результате взаимодействия с восстановителем. Восстановитель окисляется и отдает свои электроны. Находящиеся в растворе ионы присоединяют эти электроны, превращаются в свободный металл и осаждаются на изделии в виде металлической пленки.
В настоящее время разработаны методы химического покрытия металлических изделий никелем, кобальтом, железом, палладием, платиной, медью, золотом, серебром, родием, рутением и некоторыми сплавами на основе этих металлов. Наиболее широко применяют химическое никелирование и меднение. Естественно, что химическим никелированием можно наносить защитное покрытие не на любой металл. Чаще всего ему подвергают изделия из меди. Химическое никелирование позволяет покрывать детали сложной формы и внутренние поверхности, которые не доступны для покрытия гальваническим способом. В микроэлектронике химический никель наносят на детали корпусов микросхем, которые герметизируются контактными методами сварки. Химическое меднение используют для металлизации пластмасс при изготовлении печатных плат.
Неметаллические защитные покрытия. Обработку металлических поверхностей материалов и изделий неметаллическими покрытиями производят в двух случаях. Во-первых, при транспортировке, хранении и консервации в качестве временной защиты (смазка, пассивирующие пленки). Во-вторых, в ходе эксплуатации при долговременной защиты (лаки, краски, эмали, металлические покрытия). Оба класса неметаллических покрытий имеют общий недостаток, они защищают металл только единожды, пока сами не имеют повреждений.
Широкоприменяемыми и наиболее доступными из данного вида покрытий являются лакокрасочные. Высохшие пленки лаков и красок имеют низкую газо- и паропроницаемость, обладают высокими водоотталкивающими свойствами. Они предохраняют поверхность металла от контакта с водой, кислородом и других агрессивных компонентов окружающей среды. Для высокой надежности лакокрасочного покрытия поверхность металла предварительно тщательно очищают от грязи и продуктов коррозии и подвергают специальной обработке. Для стальных изделий используют так называемые преобразователи ржавчины, содержащие ортофосфорную кислоту (Н3РО4) и ее соли. Они растворяют остатки оксидов и формируют плотную и прочную пленку фосфатов, которая способна на некоторое время защитить поверхность изделия. Затем металл покрывают грунтовочным слоем, который должен хорошо ложиться на поверхность и обладать защитными свойствами (обычно используют свинцовый сурик или хроматы стронция SrCrO4, свинца PbCrO4 и цинка ZnCrO4). Данные соединения обладают ингибиторными свойствами. Проходя через слой грунтовки, вода растворяет некоторое количество содержащихся в ней соединений и становится менее коррозионноактивной. Только после этого можно наносить лак или краску.
Качество лакокрасочного покрытия определяется толщиной его слоя, равномерностью, пористостью (сплошностью), проницаемостью, адгезией и способностью набухать в воде. Пористое покрытие чаще всего образуется в ходе его формирования, а именно при испарении растворителя и удалении продуктов отверждения. Как правило, покрытие наносят в несколько тонких слоев. Толщина покрытия не должна превышать определенных величин, так как с этим связана его адгезия (сцепление) с основой. Для увеличения водоотталкивающих свойств (или снижения смачиваемости водой) лакокрасочных покрытий на них наносят пленки из восковых составов или кремнийорганических соединений. Лаки и краски лучше всего защищают металлические поверхности от атмосферной коррозии. Однако они имеют низкие защитные свойства по отношению к почвенной (подземной) коррозии.
Лакокрасочные покрытия наносят: распылением воздухом, высоким давлением и в электрическом поле; электроосаждением, струйным обливом, окунанием, валиками, кистью и т. д. Искусственная сушка красок может выполняться горячим воздухом, в камерах, инфракрасным и ультрафиолетовым излучениями.
Толстослойные битумные покрытия в отличие от лакокрасочных являются хорошей защитой подземных сооружений и конструкций.
Эмалированные покрытия бывают стекловидные и фарфоровые. Стекловидные или стеклоэмали представляют собой стекла, наносимые тонким слоем на поверхность металлических предметов. Они не только защищают последние от коррозии, но и придают им определенную окраску, улучшают внешний вид, создают отражающую поверхность и пр.
Производство эмалированных изделий включает в себя следующие операции: высокотемпературный синтез-варка эмалевых стекол (фриттов); приготовление из них порошков и суспензий; подготовка поверхности металлических изделий и собственное эмалирование - нанесение суспензии на поверхность металла, сушка и оплавление порошкообразного стекла в покрытие.
Стальные изделия грунтовой эмалью покрываются обычно двух- и трехкратно. Общая толщина получаемого покрытия в среднем равна 1,5 мм. После сушки полученного грунта при температуре 90 – 100 °С деталь далее обжигают при 850 – 950 °С. С целью увеличения долговечности эмалевых покрытий стальных труб в теплоэнергетике их наносят по слою напыленного алюминия.
Наиболее распространены стекловидные эмали – прозрачные или заглушенные. Их компонентами являются SiO2 (основная масса), B2O3, Na2O, PbO. Кроме того, вводят вспомогательные материалы: окислители органических примесей, оксиды, способствующие сцеплению эмали с эмалируемой поверхностью, глушители, красители. Эмалирующий материал получают сплавлением исходных компонентов, измельчением в порошок и добавлением в него 6 – 10 % глины. Эмалевыми покрытиями защищают сталь, а также чугун, медь, латунь и алюминий, которые применяют в пищевой, фармацевтической промышленности.
Эмали обладают высокими защитными свойствами, которые обусловлены их непроницаемостью для воды и воздуха (газов) даже при длительном контакте. Их важным качеством является высокая стойкость при повышенных температурах. К основным недостаткам эмалевых покрытий относят чувствительность к механическим и термическим ударам. При длительной эксплуатации на поверхности эмалевых покрытий может появиться сетка трещин, которая обеспечивает доступ влаги и воздуха к металлу вследствие чего и начинается коррозия. Основные недостатки таких покрытий - хрупкость и растрескивание при тепловых и механических нагрузках.
В основе фосфатирования стальных изделий лежит процесс образования нерастворимых в воде двух- и трехзамещенных фосфатов железа, марганца или цинка. Они образуются при контакте изделия с раствором разбавленной ортофосфорной кислоты Н3РО4 с добавками однозамещенных фосфатов (дигидрофосфатов) вышеперечисленных металлов, а именно Fe(H2PO4)2 и Mn(H2PO4)2 или Zn(H2PO4)2. Фосфатирование проводят окунанием или распылением при температуре около 100 °С. В производственных условиях используют также электрохимический способ - обработку изделий переменным током в растворе фосфата цинка при плотностях тока 4 А/дм2, напряжении 20 В и 60 - 70 °C. Процесс фосфатирования ведется 40 - 90 мин. Для его ускорения в раствор добавляют 50 - 70 г/л нитрата цинка. При этом время процесса уменьшается в 10 - 12 раз.
Получающийся фосфатный пласт окрашен в серо-черный цвет и хорошо сцеплен с металлической основой. Толщины фосфатных слоев составляют 10 - 20 мкм. Эти покрытия пористы, поэтому на них дополнительно нужно нанести лак или краску.
Фосфатные покрытия являются хорошей защитой лишь от атмосферных осадков. Однако они практически не защищают металлы от растворов солей и даже слабых растворов кислот. Но в тоже время, фосфатный слой уменьшает коррозионные разрушения при образовании царапин или других дефектов. Фосфатирование металлической поверхности чаще всего играет роль грунтовки при нанесении покрытий из лаков, красок и смол.
В качестве керамической защиты используются покрытия на основе оксидов некоторых легкопассивирующихся металлов (Al-Al2O3; Fe-Fe3O4; Cr-Cr2O3 и т. д.) а также кремниземистые, алюмосиликатные, магнезильные, карборундовые и другие. Многие оксидные пленки жаростойки (Al2O3, Cr2O3 и т.д.). Процесс нанесения на сталь оксидной пленки магнетита (Fe3O4) называется воронением стали. Такие металлы, как тантал, ниобий, бериллий, надежно защищаются оксидными пленками от коррозии в атмосферных условиях.
Создавая оксидные или солевые пленки, можно проводить окраску или тонирование металлов. Толщина таких пленок соизмерима с длиной волны видимого света, поэтому цвет тонированной поверхности зависит от толщины покрытия и цвета металла. Для химического оксидирования с целью окраски широко используют персульфатный раствор, а для электрохимического - изделие делают анодом. В последнем случае говорят, что окрашивание проводят путем анодирования. Тонированию чаще всего подвергают изделия из меди и ее сплавов, а также из алюминия, олова, никеля.
Тонирование также можно осуществлять в растворе, содержащем: сульфат меди CuSO4 (10 - 12 г/л), нитрат свинца Pb(NO3)2 (10 - 12г/л), тиосульфат натрия Na2S2O3 (100 - 180 г/л) и сегнетову соль (15 - 20 г/л). В зависимости от времени выдержки в данном растворе при комнатной температуре получают следующую цветовую гамму покрытий: желтый (5 мин), коричневый (7 мин), красный (10 мин), фиолетовый (13 мин), синий (17 мин), зеленый (20 мин). Электрохимический метод тонирования отличается более широкой цветовой гаммой и лучшей воспроизводимостью цветов по сравнению с химическим.
Воронение сталей представляет собой термический способ их оксидирования. Его проводят на воздухе при 350 - 360 °C. Металлические поверхности предварительно покрывают тонким слоем 15 – 20 %-ного раствора асфальтового лака в бензине и подсушивают на воздухе. При оксидирующей обработке материалов и изделий в кипящем растворе щелочей в присутствии нитратов (соли азотной кислоты) и нитритов (соли азотистой кислоты HNO2) s-металлов первой группы формируется такое же оксидное покрытие. Оксидирование металлов в промышленных масштабах осуществляют не только для их противокоррозионной защиты и декорировки изделий, но и для придания электроизоляционных свойств поверхностному слою и увеличению коэффициента отражения зеркал. Оксидный слой также используют в качестве грунта под окраску и лакировку.
Получили развитие новые материалы, называемые керметы. Это металлокерамические смеси или комбинации металлов с керамикой, например Al - Al2O3 (САП), V – Al - Al2O3 (твэл). Они находят применение в реакторостроении. По сравнению с простой керамикой керметы обладают большей прочностью и пластичностью, имеют очень высокую сопротивляемость механическим и тепловым ударам.
Нанесение слоев из порошков полимеров осуществляют газопламенным, вихревым и электростатическим напылением. При температуре 650 -700 °С порошкообразный полимер размягчается и при ударе о подготовленную и нагретую до температуры давления полимера поверхность детали сцепляется с ней, образуя сплошное покрытие. Для напыления успешно используют полиэтилен, поливинилхлорид, фторопласты, нейлон и другие полимерные материалы. Для замедления коррозии на поверхность металла наносят лаки и краски, минеральные масла и смазку. Подземные конструкции покрывают толстым слоем битума или полиэтилена. Внутренние поверхности стальных труб и резервуаров защищают дешевыми покрытиями из цемента. Недостаток цементных покрытий тот же, что и эмалевых, – высокая чувствительность к механическим ударам.
Перед нанесением любого вида покрытия поверхность изделия следует очистить от загрязнений. Тщательная очистка это одно из важных условий получения качественного покрытия и высокой адгезии. К загрязнениям относят жиры, масла, окалину, ржавчину, пыль и др. Обработку поверхности производят различными способами в зависимости от вида формирования пленки.
Ингибиторная защита. Применение ингибиторов - один из эффективных способов борьбы с коррозией материалов в различных агрессивных средах (атмосферных, морской воде, охлаждающих жидкостях и солевых растворах, окислительных условиях и т. д.). Ингибиторы коррозии - это вещества, замедляющие скорость разрушения металлических изделий. Они обычно применяются в малом объеме агрессивной среды. Даже в малых концентрациях (10-3 - 106 моль/л) они заметно снижают скорость обоих механизмов разрушений. Название ингибитор происходит от латинского слова «inhibere», что означает сдерживать, останавливать. Их вводят в рабочую агрессивную среду или наносят на детали. Они адсорбируются на металлической поверхности, взаимодействуют с ней с образованием защитных пленок, тормозят анодные и катодные процессы, повышают потенциал металла и тем самым препятствуют протеканию разрушительных процессов. Таким образом, по механизму действия их классифицируют на катодные (уменьшение потенциалов катодных областей), анодные (рост потенциалов анодных зон) и экранирующие (деактивируют поверхности металла). Некоторые антиоксиданты способствуют удалению кислорода (или другого окислителя) из рабочей зоны, что также снижает скорость коррозии.
По агрегатному состоянию различают парофазные или летучие и жидкофазные или контактные ингибиторы. Последние классифицируют по типу агрессивной среды на замедлители разрушений в нейтральных, кислых и щелочных растворах. По химическому составу они бывают органические, неорганические и в виде разнообразных смесей на их основе.
Замедлители коррозии известны достаточно давно. Однако как всегда они были найдены ненароком при использовании для этих целей различных веществ. Так на Руси, а именно на Урале оружейные мастера для предотвращения образования ржавчины на ружьях и копьях использовали растворы серной кислоты с добавлением мучных отрубей. Они называли их «травильными супами». Аналогичные растворы, но с прибавлением к ним муки, пивных дрожжей и крахмала применяли и дамасские мастера.
Ингибиторы широко употребляют при химической очистке паровых котлов от накипи, снятии окалины методом кислотной промывки, а также при хранении и перевозке неорганических сильных кислот в стальной таре и других.
Самым простым замедлителем атмосферной коррозии является нитрит натрия NaNO2. Из него готовят концентрированные растворы, а также коллоидные смеси с глицерином и производными целлюлозы, в частности, оксиэтил- или карбоксиметилцеллюлозой. Более эффективными являются гелевые растворы. Срок хранения деталей и конструкций, обработанных такими киселями, в 3 - 4 раза больше по сравнению с водными растворами. Для безопасного хранения деталей из стали и чугуна применяют именно водные растворы нитрита натрия. Стальные изделия окунают в 25 %-ные растворы, а чугунные в 40 %-ные. По завершении операции детали обертывают парафиновой бумагой.
Для солянокислотной промывки теплосилового оборудования используют ингибиторы, представляющие собой смесь высших пиридиновых оснований.
Жидкофазными ингибиторами в нейтральных средах являются растворимые нитриты, хроматы, фосфаты, гидрофосфаты, бензоаты металлов, в том числе NaNO2, Na2Cr2O7, Na3PO4 соответственно. Они же относятся к анодным замедлителям. Их действие связано с пассивацией поверхности металлов. Так нитриты и хроматы оказывают окисляющее действие, фосфаты и гидрофосфаты приводят к формированию пленок малорастворимых соединений, бензоаты же обладают адсорбционными свойствами. Данные ингибиторы замедляют в основном анодные процессы, увеличивают стационарные потенциалы.
Катодными ингибиторами являются в основном азот-, кислород- и серосодержащие органические вещества, в частности, различные амины, имины, тиосоединения, а также карбоксильные и карбонильные углеводороды. Например, диэтиламин, уротропин, формальдегид, тиокрезол и др. Эти же вещества используются в качестве замедлителей коррозионных процессов в кислых средах. Из указанных соединений жидкофазными ингибиторами служат эфиры моно- и дикарбоновых кислот. Они применяются для ослабления термо- и оксидеструкции масел и смазок.
Яркими представителями парофазных (летучих) ингибиторов кислотного действия являются нитриты различных аминов, смеси аминов с нитритом натрия, моноэтаноламин и др. Воздействие этих замедлителей часто усугубляется добавлением поверхностноактивных веществ (ПАВ), в качестве которых применяются растворимые галогениды, сульфиды и роданиды металлов (например, NaCNS). Данные ингибиторы используют для защиты металлических материалов, изделий и оборудования при транспортировке, хранении и эксплуатации в воздушной атмосфере. Например, детали небольших размеров при хранении и перевозке заворачивают в бумагу, хорошо пропитанную моноэтаноламином. Чаще всего такие замедлители помещают в контейнеры, упаковочные средства, в которых находятся металлические материалы и изделия, а также располагают рядом с эксплуатирующимся оборудованием. Механизм действия кислотных ингибиторов заключается в следующем. Из мест своего расположения они попадают в воздух, контактирующий с металлом. Далее растворяются в слое атмосферной влаги, которая покрывает металл. Затем адсорбируется из этого раствора на поверхность металла, тормозят коррозионные процессы и снижают скорость разрушений. При выборе ингибиторов к ним предъявляются требования пониженной токсичности.
В щелочных средах замедляющим действием обладают лишь некоторые высокомолекулярные соединения.
Электрохимическая защита. Из всех применяемых методов борьбы с коррозией самым эффективным является электрохимическая защита. Данный метод используется как мера борьбы с подземной (почвенной) и морской коррозией.
Электрохимическая защита классифицируется на: протекторную, катодную, анодную и электродренаж.
При протекторной защите основной металл является катодом, а роль протектора (анода) играет подсоединенный к изделию кусок более активного металла (магний Mg, алюминий Al, цинк Zn и их сплавы) (рис. 1.109). Металл-анод разрушается, а основной металл оборудования сохраняется. Основными факторами, влияющими на интенсивность защиты, служат разность потенциалов между металлами-электродами, электропроводность среды и тип расположения протектора.
Катодная защита относится к активным мерам предохранения оборудования, находящегося во влажной почве или в воде. При этом используют источник постоянного тока (рис. 1.110), отрицательный полюс которого подключается к защищаемому металлическому оборудованию, а положительный - к вспомогательному инертному аноду. Катодная защита применяется в сочетании с некоторыми видами покрытий. Требуемый при этом ток мал и служит только для защиты обнаженных участков поверхности металла. Для катодной защиты стали в почве и нейтральных водных растворах минимальный потенциал составляет 770 – 780 мВ. Предусматривается одновременная пленочная изоляция поверхности изделия от контакта с коррозионной средой.
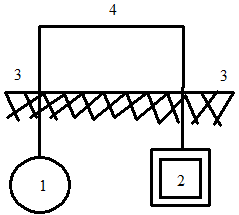
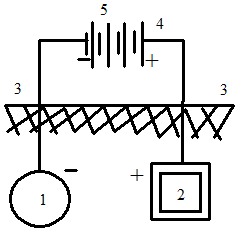
| Рис. 1.109. Схема протекторной защиты с разрушающимся анодом: 1 - защищаемое изделие; 2 – протектор (анод); 3 - грунт; 4 - металлический провод | Рис. 1.110.Схема катодной защиты с низковольтным источником постоянного тока: 1 - защищаемое изделие; 2 - анод; 3 - грунт; 4 - металлический провод; 5 - источник постоянного тока |
Анодную защиту применяют только для оборудования из сплавов, склонных к пассивации в данном технологическом растворе. Коррозия этих сплавов в инертном состоянии протекает гораздо медленнее. Используется источник постоянного тока с автоматическим регулятором потенциала анодной поляризации защищаемого металла. В зависимости от агрессивности среды при анодно-протекторной защите применяют катоды из кремнистого чугуна, молибдена, сплавов титана и нержавеющих сталей. Так предохраняют теплообменники из нержавеющих сталей, работающие в 70 – 90 %-ной серной кислоте при температуре 100 – 120 °С.
К электрохимическим методам борьбы с коррозией можно отнести и защиту от разрушения конструкций блуждающими токами. Одним из способов устранения такой коррозии является соединение металлическим проводником участка конструкции, с которого стекает блуждающий ток, с рельсом, по которому движется трамвай или электропоезд.
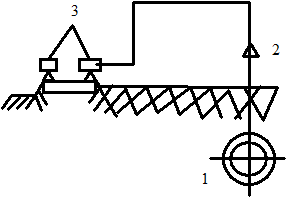
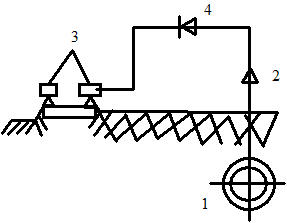
Наилучшим предохранением является электрический дренаж. Металлические проводники отводят блуждающий ток от анодной зоны уложенного оборудования обратно в исходный замкнутый электрический контур (рис. 1.111). При постоянном положении анодной зоны достаточно подключить уложенное оборудование к начальному контуру блуждающего тока, т. е. выполнить так называемый прямой электрический дренаж (рис. 1.111а). Однако им пользуются крайне редко. Если расположение анодной зоны изменяется, необходимо включить в контур электрический вентиль, который исключит передачу электрического тока от дренажа к уложенному оборудованию (рис. 1.111б).
|
|
Рис. 1.111. Защита оборудования от блуждающих токов с помощью электрического дренажа: а - прямой электрический дренаж; б - дренаж с запирающим электрическим вентилем в контуре; 1 - защищаемый трубопровод; 2 - электрический контур; 3 - электрифицированная дорога; 4 - запирающий электрический вентиль
Изменение условий среды. Скорость коррозии металлических материалов можно снизить, уменьшая агрессивность среды. Это достигается ее соответствующей обработкой различными способами. Так, например, из нейтральных солевых сред и пресной воды кислород удаляют деаэрацией (кипячение, дистилляция, барботаж инертным газом). Данный способ применяется для воды, используемой в котельных установках.
Эффективны и химические методы связывания кислорода соответствующими реагентами (сульфиты, гидразин и т. п.). Например, в случае применения гидразина кислород восстанавливается до воды, а гидразин окисляется до свободного азота (реакция 1.29).
N2H4 + O2 = N2 + 2H2O (1.29)
Уменьшение концентрации кислорода почти линейно снижает предельный ток его восстановления, а следовательно, и скорость коррозии металла.
Агрессивность среды уменьшается также при ее подщелачивании, снижении общей концентрации солей и замене более агрессивных компонентов менее активными. При противокоррозионной подготовке воды для уменьшения накипеобразования широко применяется ее очистка ионнообменными смолами.
Относительная влажность атмосферы в герметизированных помещениях поддерживается постоянно не более 60 % за счет применения специальных осушителей, в частности, силикагеля и др.
Еще один способ – это корректировка технологических параметров эксплуатации оборудования, а именно, температуры, давления, а также скорости потока жидкости и др.
Например, передвижение парогазовой смеси по стальным трубопроводам допускается лишь при условии, что температура по всей протяженности тока не снижается ниже точки росы. При необходимости используют нагреватели или теплообменники.
Коррозию стенок стальных теплообменников снижают, регулируя тепловой режим так, чтобы температура выходящей воды была не более 60 °С.
Увеличение коррозионной стабильности основного материала. Данный метод защиты от коррозии применяется в основном для тех металлических материалов, которые являются достаточно коррозионностойкими из-за наличия на их поверхности естественных защитных пленок. К ним относятся алюминий, хром, цинк, никель и др.
Например, для защиты алюминиевых конструкций применяется химическое или электрохимическое утолщение окисной пленки до 0,025 - 0,055 мм (анодное оксидирование или анодирование), защита протекторами, полирование и окраска или покрытие лаками.
Анодное оксидирование состоит в том, что деталь, соединенную с анодом, погружают в электролит (раствор серной или хромовой кислоты). При прохождении тока на детали выделяется кислород, образующий окисную пленку. Последующей промывкой в растворе органических красителей изделиям сообщается синий, зеленый, красный или другой цвет.
При химическом оксидировании можно получить защитную пленку золотистого цвета толщиной до 0,003 мм. Если при работе деталь из алюминиевого сплава соприкасается с другими деталями, ее можно защитить протектором, в качестве которого служит нанесенный на деталь слой цинка, кадмия (плакирование). С этой же целью можно применять также прокладки из цинка, резины, фибры, бакелита и т. д. Полирование выполняется механическим, химическим или электрохимическим способом.
Защита от радиации. Радиационные дефекты способны изменять как поверхностные, так и объемные свойства сплава. Поэтому к конструкционным материалам предъявляют следующие требования: высокая механическая прочность и пластичность, термическая стабильность, коррозионная стойкость и теплопроводность, совместимость с различными материалами, низкое сечение поглощения нейтронов, большая радиационная стабильность, малая наведенная радиоактивность и высокое сечение рассеяния нейтронов, большая потеря энергии нейтронов за одно столкновение.
Стойкость к радиации – это стабильность структуры и служебных свойств в условиях облучения материала. Последствия облучения на физические, тепловые и механические свойства реакторных материалов можно устранить отжигом. Некоторые дефекты, вызывающие радиационную деградацию свойств материала, можно частично отжечь путем увеличения температуры и длительности процесса. Различают два типа такого отжига: термический и радиационный. Однако отжиг не устраняет дефекты, вызванные радиационным распуханием. Для исправления этих недостатков используют три способа. Первый метод заключается в изменении содержания некоторых легирующих компонентов (хрома и никеля) в сталях. По второму типу легирование сталей осуществляют малыми количествами кремния, никеля, титана, циркония и молибдена, а также уменьшают концентрации таких газовых включений, как гелия, кислорода, азота и водорода. Третий способ включает модификацию микроструктуры материала за счет снижения размера зерен и создания в структуре устойчивой дисперсной фазы.
С повышением концентрации никеля склонность сплава к радиационному распуханию уменьшается, а хром оказывает обратное влияние. Среди систем железо-хром-никель наиболее стойкими к распуханию оказались те, у которых концентрация никеля составляет 35 – 60 %, а хрома менее 20 %. Добавление в такие сплавы небольшого количества празеодима (примерно 0,4 %) приводит к существенному снижению распухания. Увеличение объема материала достигает при облучении всего лишь 1 %. Снижение среднего размера зерна структурных составляющих от 3,77 до 0,45 мкм приводит к уменьшению степени распухания материала из нержавеющей стали марки 1Х18Н9Т на порядок величины.
Защита от воздействия микроорганизмами. Защита металлических изделий от воздействия микроорганизмов может быть достигнута путем проведения ряда мероприятий, направленных на устранение микроорганизмов вызывающиx или усиливающих процессы коррозии, ограничение их доступа к техническим изделиям, а также на уничтожение или приостановление их активной деятельности. К этим мероприятиям относят проветривание, осушение воздуха окружающей среды, поддержание чистоты в помещениях, гидрофобизирование поверхностей, применение биоцидных препаратов (дезинфицирующих растворов ингибиторов - фунгицидов и пр.), катодную защиту и др. Большинство из этих мероприятий, наряду с обеспечением защиты от коррозии металлов, предохраняют от микробиологических повреждений полимерные и другие неметаллические материалы.
Создание коррозионностойких материалов заключается в разработке их новых видов, иногда не содержащих в своем составе металлов. Это материалы-металлозаменители. Сюда могут относиться различные пластмассы, резины, керамика и др., а также композиты на их основе.
Дата добавления: 2015-09-21; просмотров: 11769;
