Компоненты железоуглеродистых сплавов
Сплавы железа принято в промышленности называть черными металлами, остальные металлы - цветными.
Железо. Впервые о железе стало известно во 2 в. до н.э. как о метеоритном железе. В Европе и Древней Руси железо получали сыродутным путем (восстановление железа из железной руды в горне, устроенном в яме, в которую мехами вдували воздух). Продукт восстановления – крицу – ударами молота отделяли от шлака и из нее выковывали различные изделия. По мере усовершенствования процессов дутья, высоты горна повышалась температура в нем и железо науглероживалось. Т.о. получался чугун, который считали отходом производства. До сих пор его называют "чушками". Позже заметили, что при загрузке в горн не руды, а крицы получали более качественный металл – сталь. В 14 в. чугун стали выплавлять не как кричный передел, а металл для литья каких-либо изделий. Тогда же произошла реконструкция горна в шахтную печь – "домницу", а далее в домну. Промышленный переворот 18-19 вв., изобретение паровой машины, железной дороги, мостов, парового флота вызвали громадную потребность в сталях. Массовое производство стали началось в 19 в., были разработаны бессемеровский, мартеновский сталеплавильные процессы. В 20 в. был изобретен электросталеплавильный процесс, дающий сталь высокого качества.
Железо - металл серебристо-белого цвета, является переходным металлом, находится в VIII-ой группе Периодической системы. Его атомный номер 26, атомная масса 55,8 а.е.м., атомный радиус 0,127 нм. Температура плавления - 1539°С.
Атом железа имеет внешнюю электронную конфигурацию 3d64s2. Валентность железа +2 и +3.
Железо устойчиво по отношению к сухому воздуху, но во влажном - быстро корродирует и покрывается бурым гидроксидом Fе2О3*nН2О, рыхлым и не предохраняющим металл от дальнейшего окисления (ржавчиной). Реакция образования ржавчины многостадийна:
4Fе + 3О2 + 2nH2О = 2(Fе2О3*nН2О)
При температуре каления железо сгорает, превращаясь в "железную окалину" Fе3О4.
При нагревании железо взаимодействует с неметаллами (С, Si, N,P, Н) с образованием металлоподобных соединений (Fe3С, Fe3Si, Fe3P, Fe3N и др.). Железо легко растворяется в кислотах, вытесняя водород.
Способ получения железа из руд основан на восстановлении оксидов железа углем.
Железо - полиморфный металл, может существовать в четырех модификациях:
a - ОЦК от 0°Кдо769°С; b - ОЦК от769°до910°С
g - ГЦК от 910° до 1329°С; d - ОЦК от 1329 °С
до температуры плавления Тп = 1539 °С.
Плотность "низкотемпературной" модификации a -Fe равна 7,68* 103кг/м3. Параметр решетки a = 0,286 нм.
При Т( a-b )=769°С a - фаза переходит в b - фазу - модификацию с незначительным изменением параметра решетки, но существенным изменением магнитных свойств.
a - фаза склонна к сильному намагничиванию и является ферромагнитной фазой. При 769°С ферромагнит превращается в парамагнит b -Fe, а данная температура Т( a-b ) называется температурой Кюри. При Т( b-g )= 910 °С b -Fe превращается в g - ГЦК - модификацию с плотностью r = 8*103 кг/м 3 и параметром а=0,365 нм. g - Fe при Т( g-d)=1392 превращается в d - Fe (ОЦК), которое плавится при 1539°С.
Углерод - неметалл, находится в IV-й группе Периодической таблицы, атомный номер 6, атомная масса 12 а.е.м., атомный радиус 0,077 нм, температура плавления 3500 °С. Углерод полиморфен, имеет аллотропные формы: графит и алмаз.
При взаимодействии с железом в сплавах углерод может растворяться в решетках железа по механизму внедрения в межузельные пространства решетки железа, поскольку атомный радиус углерода почти в два раза меньше, чем у железа. Кроме того, углерод с железом образует химические соединения Fe3С, Fe2C и др. Соединение Fe3С является устойчивым, содержит наименьшую концентрацию углерода (6,67 % С) по сравнению с другими соединениям. Соединение Fe2C является неустойчивым, т.е. распадается с понижением температуры. Сплавы, содержащие более 6,67% С очень хрупкие и не применяются в производстве, поэтому можно рассматривать часть диаграммы от железа до соединения Fe3С как самостоятельную диаграмму Fe-Fе3C.
В природе имеются месторождения кристаллического, связанного с магматическими горными породами – Бурятское месторождение, и скрытокристаллического графита, связанного с метаморфизмом углей –крупное Уральское месторождение, содержание графита в сланцах 60-85%. Высокая жаропрочность графита позволяет применять его как огнеупорный материал в литейных формах, тиглях, керамики, для изготовления антипригарной краски и т.д.; как эрозионностойкий материал для покрытия сопел ракетных двигателей, камер сгорания; высокая электропроводность позволяет применять как гальванические элементы, щелочные аккумуляторы, скользящие контакты, проводящие покрытия; малый коэффициент трения позволяет применять как смазочный и антитфрикционный материал.
1.2. Диаграмма состояния железо-цементит (Fe-Fе3C)
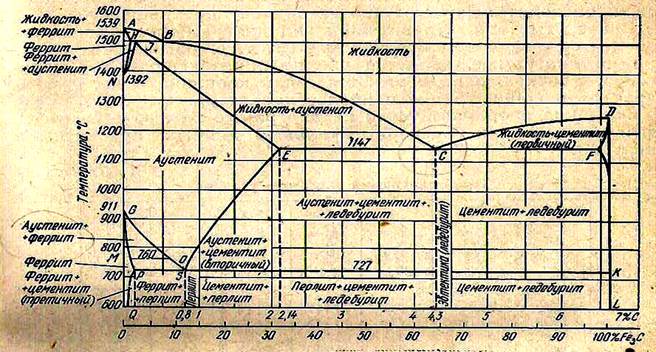
Рис. 1.1. Диаграмма состояния железо-углерод
Эта диаграмма характеризует состояния железоуглеродистых сплавов - сталей и белых чугунов с концентрацией углерода от 0 до 6,67%С. Концентрация 6,67 % С соответствует содержанию углерода в карбиде железа Fe3С. Карбид железа Fe3С не является стабильным и легко распадается с образованием углерода.
1.3. Структурные составляющие в системе Fe – Fe3С
Феррит - твердый раствор внедрения углерода в a - (ОЦК) железе. Различают низкотемпературный (Fеa) и высокотемпературный (Feg) феррит. Феррит, является твердым раствором внедрения. Атомы углерода располагаются в решетке a -Fe в межузлиях. Из-за малых размеров этих пор в ОЦК-решетке (0,291 г, где r - радиус атома железа) значительная часть атомов углерода располагается на дефектах (вакансиях, дислокациях). Этим объясняется малая растворимость углерода в a -Fe. Максимальная концентрация углерода в феррите - 0,02 % при 727°С, а при комнатной температуре - 0,006 %.
Феррит мягок и пластичен. Он имеет следующие механические свойства:
sв = 250 МПА; sо,2 = 120 МПА; d = 50 %; y = 70 %;
KCU = 2,5 МДж/м2; НВ = 80 кгс/мм2.
Так же, как и a-Fe, феррит магнитен до 768 °С.
Под микроскопом феррит выявляется в виде однородных светлых зерен. Обозначают феррит буквой Ф (либо a-фаза).
Аустенит - твердый раствор внедрения углерода в g - (ГЦК) железе. Кристаллическая решетка аустенита - ГЦК. Размер пор в ГЦК-решетке почти в 2 раза больше, чем в ОЦК-решетке. Поэтому растворимость углерода в g-Fe больше, чем в a - Fe. Максимальная концентрация углерода в аустените - 2,14 % при 1147 °С и 0,8 % при 727 °С. Аустенит, так же как и g -Fe, немагнитен (парамагнитен). Аустенит пластичен d = 40 ¸ 50 %, НВ = 160 ¸ 200 кгс/мм2. Обозначают аустенит буквой А (либо g - фаза). Аустенит имеет пластинчатое строение с прямыми границами.
Цементит - химическое соединение Fe3С и содержит 6,67% С (карбид железа). Кристаллическая решетка цементита - сложная. Он тверд (HV = 1000, НВ=800 кгс/мм2), легко царапает стекло и хрупок. Условно температуру плавления цементита считают ~ 1250°С, хотя он до этого не доходит и распадается на железо и графит. Обозначают цементит буквой Ц (или Fe3С).
Перлит – механическая эвтектоидная смесь феррита и цементита, содержит 0,8%С. Образуется из аустенита при температуре Т=727 0С.
d = 25 %; НВ = 250 кгс/мм2.
Под микроскопом перлит выглядит в виде зерен с пластинчатым или зернистым чередованием феррита и цементита. Обозначают перлит буквой П.
Ледебурит – эвтектическая смесь аустенита и цементита (после первичной кристаллизации) либо перлита и цементита (после перекристаллизации). Содержит 4,3%С.
d = 1 %; НВ = 600 кгс/мм2.
Под микроскопом перлит выглядит в виде зерен с серыми зернами перлита на белом фоне цементита. Обозначают перлит буквой Л.
1.4. Характеристика отдельных точек и линии диаграммы Fe-Fe3С
А - температура плавления чистого железа (1539 °С)
Д - температура плавления цементита (ТL ~ 1250°С)
N - Т( dÛg ) = 1392°Сü полиморфные
G - T( gÛa ) = 911°Сþ превращения
АВСCD - линия ликвидуса (начало первичной кристаллизации).
АHIЕCF – линия солидус (окончание первичной кристаллизации).
HJB – перитектическая горизонталь (1499 0С).
ECF - эвтектическая горизонталь (1147 0С).
PSK - эвтектоидная горизонталь (727 0), линия окончания вторичной кристаллизации у сталей, линия перекристаллизации чугунов, точки А1 для сплавов.
GSE – линия начала вторичной кристаллизации у сталей, точки А3 для сплавов.
SE - линия предельной растворимости углерода в g -Fe
NH и NJ - начало и конец полиморфного превращения высокотемпературного феррита в аустенит (и аустенита в феррит), точки А4 для сплавов.
PQ - линия предельной растворимости углерода в a- Fe.
Левая верхняя часть диаграммы представляет экзотический интерес, поэтому мы не будем подробно ее рассматривать.
Эвтектика (точка С) – механическая смесь, образующаяся при кристаллизации жидкого раствора.
Эвтектоид (точка S) – механическая смесь, образующаяся при распаде твердого раствора.
Перитектика (точка J) – твердый раствор, образованный из двух других фаз, отличных от образованной фазы.
Все сплавы железа с углеродом с содержанием до 2,14 %С называют сталями.
Стали классифицируют по структуре в зависимости от содержания углерода:
- сталь с С = 0,8 % - _ эвтектоидная сталь,
- сталь с С < 0,8 % - _ доэвтектоидная сталь
- сталь с С > 0,8 % - _ заэвтектоидная сталь
Сплав с концентрацией углерода < 0,02 % называют - техническим железом.
Сплавы с содержанием углерода более 2,14 до 6,67 %С, в которых кристаллизация происходит с образованием эвтектики (ледебурита), называются чугунами.
Существуют белые и серые чугуны. В белых чугунах весь углерод находится в химически связанном состоянии Fe3С. В серых чугунах цементит распадается с образованием свободного углерода – графита.
Белые чугуны по содержанию углерода делят на:
- доэвтектические (С < 4,3 %)
- эвтектические (С = 4,3 %)
- заэвтектические (С > 4,3 %)
Первичная кристаллизация белых чугунов происходит при 1147°С. Перекристаллизация – при 727 0С.
Таблица 1.1
Координаты точек диаграммы железо-углерод
| Точка | Температура, 0С | Концентрация углерода |
| A | ||
| B | 0,5 | |
| C | 4,3 | |
| N | ||
| H | 0,1 | |
| J | 0,16 | |
| G | ||
| E | 2,14 | |
| S | 0,8 | |
| P | 0,02 | |
| Q | 0,006 | |
| D |
Первичная кристаллизация сталей с содержанием углерода до 0,16% начинается с выделения из жидкости дендритных кристаллов δ-феррита. При температуре перитектического превращения оставшаяся жидкость и δ-феррит образуют новую фазу – аустенит. Он охлаждается до температуры линии GSE , когда начинается вторичная кристаллизация с выделением кристаллов α-феррита (у чистого железа полиморфное превращение γ→α происходит при одной температуре, а в сплавах за промежуток температур). Далее оставшийся аустенит при Т=727 0С претерпевает эвтектоидное превращение с перекристаллизацией в перлит с попеременным выделением пластин или зерен цементита и феррита.
При кристаллизации доэвтектического чугуна из жидкости выделяются дендритные кристаллы аустенита, а заэвтектического – цементита. При температуре эвтектики начинается образование ледебурита – попеременная кристаллизация пластин аустенита и цементита. Далее аустенит, который находится в ледебурите (как и в сталях), при Т=727 0С претерпевает эвтектоидное превращение с перекристаллизацией в перлит с попеременным выделением пластин или зерен цементита и феррита.
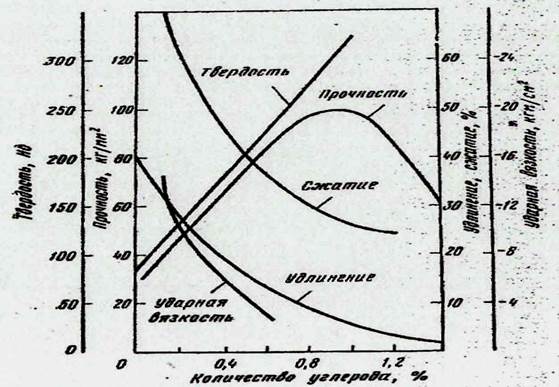
Рис. 1.2. Влияние содержания углерода на механические свойства стали
По своей структуре стали представляют смесь мягкого технического железа и твердого цементита, и этого уже достаточно, чтобы понять возможность довольно широкого набора механических свойств в сплавах с различным содержанием углерода (рис. 1.2). Из рис. 1.2 видно, что просто на основе изменения содержания углерода и соответственно изменения доли содержания цементита в структуре можно иметь материал с твердостью от НВ=80 до НВ≈350. Зато прочность повышается при содержании углерода до ≈1,1%, а затем падает, т.к. большое содержание углерода по границам зерен приводит к охрупчиваю стали.
Дата добавления: 2015-09-18; просмотров: 1711;
