Теоретическое введение. Соединения, в состав которых входят комплексные ионы, способные существовать как в кристаллах, так и в растворах
Соединения, в состав которых входят комплексные ионы, способные существовать как в кристаллах, так и в растворах, называются комплексными. Комплексные соединения могут быть получены при взаимодействии нейтральных молекул:
Fe(CN)3 + 3KCN = K3[Fe(CN)6]; BF3 + KF = K[BF4]
В молекуле комплексного соединения один атом или ион, обычно положительно заряженный, занимает центральное место и называется комплексообразователем. В непосредственной близости к нему расположены или координированы противоположно заряженные ионы или нейтральные молекулы, называемые лигандами. Комплексообразователь и лиганды образуют внутреннюю сферу комплексного соединения. Число лигандов, расположенных вокруг комплексообразователя, называется координационным числом.Чаще всего координационное число равно 6, 4 и 2. В формулах комплексных соединений внутреннюю сферу обозначают квадратными скобками. Все остальные ионы, не вошедшие во внутреннюю сферу, составляют внешнюю сферу.
При растворении в воде комплексные электролиты диссоциируют на внутреннюю и внешнюю сферу: [Ag(NH3)2]Cl ↔ [Ag(NH3)2]+ + Cl‾. Наряду с этим происходит и другой процесс, хотя в значительно меньшей степени:
[Ag(NH3)2]+ ↔ Ag+ + 2NH3. Здесь диссоциация протекает обратимо и равновесие резко сдвинуто влево. Константа диссоциации комплексного иона
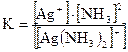
называется константой нестойкости (Кн). Она характеризует устойчивость комплекса. Чем меньше константа нестойкости, тем прочнее комплексный ион в растворе.
Дата добавления: 2015-09-11; просмотров: 750;
