Гемоглобиновая буферная система
Гемоглобиновая буферная система является сложной буферной системой. В её составе в качестве донора протона выступают две слабые кислоты: гемоглобин ННb и оксигемоглобин НнbO2. Роль акцептора протона играют анионы этих кислот (сопряженные кислотам основания) Hb ‾ и HbO2 ‾. Механизм буферного действия этой системы основан на следующих реакциях:
H+ + Hb‾ ↔ HHb pKa (HHb) = 8,20
H + + HbO2 ‾ ↔ HHbO2 ↔ HHb + O2 pKa (HHbO2) = 6,95
При добавлении кислот поглощать ионы Н+ будут в первую очередь анионы гемоглобина, которые имеют большое сродство к протону.
При добавлении основания оксигемоглобин будет проявлять большую активность, чем гемоглобин:
OH ‾ + HHbO2 ↔ HbO2 ‾ + H2O OH ‾ + HHb ↔ Hb ‾ + H2O
Гемоглобиновая буферная система крови играет значительную роль сразу в нескольких физиологических процессах: дыхании, транспорте кислорода в ткани и в поддержании постоянства рН внутри эритроцитов, а в конечном итоге – в крови. Буферная система крови успешно функционирует только вместе с другими буферными системами крови.
Белковые и аминокислотные буферные системы
Значительную долю буферной ёмкости крови обеспечивают белковые буферные системы (гемоглобин, оксигемоглобин, белки плазмы).
Молекулы белков (Prot-H) содержат остатки аминокислот H2N – CHR – COOH, которые проявляют себя как амфотерные электролиты. В их молекулах группы –СООН имеют слабые кислотные, а –NH2 ─ слабоосновные свойства. Соответственно, белки противодействуют как подкислению, так и подщелачиванию среды.
Белковая буферная система работает совместно с гидрокарбонатной системой:
CO2 + H2O ↔ H2CO3 ↔ HCO3 ‾ + H + (а)
Prot-H ↔ Prot ‾ + H + (б)
Равновесия (а) и (б) тесно связаны между собой. Рост концентрации СО2 (например, при мышечной работе или за счёт снижения скорости удаления при дыхательной недостаточности) сдвигает реакцию (а) вправо, а реакцию (б) – влево.
Следовательно, увеличение концентрации бикарбонат-иона соответствует снижению концентрации Prot ‾. Сумма концентраций HCO3 ‾ и Prot ‾ остаётся неизменной благодаря совместному действию этих буферных систем.
Если ионы водорода возникают из других источников (диабетический кетоз, образование молочной кислоты при гипоксии и т.д.), то обе реакции сдвигаются влево, образуются формы Prot-H и CO2, при этом избыток СО2 удаляется через лёгкие.
Аминокислотные буферные растворы
Рассмотрим в качестве примера простейшую аминокислоту – глицин (аминоуксусная кислота). Глицин существует в водном растворе в виде биполярного иона:
H2N – CH2 – COO ↔ H3N – CH2 – COO ‾
R ↔ R
Концентрация биполярных ионов R в водном растворе глицина в 224 000 раз больше концентрации нейтральных молекул R.
Если к водному раствору глицина добавить сильную кислоту, то он присоединит протон по группе - COO ‾ с образованием катиона глицина R +. При добавлении к раствору глицина щелочи группа H3N + - отдаст протон, образуя анион глицина R ‾:
+ H + + H +
H3N – CH2 – COOH ↔ H3N – CH2 – COO ‾↔ H3N – CH2 – COO ‾
R + (катион глицина) биполярный ион R ‾(анион глицина)
Из схемы видно, что катион глицина R + можно рассматривать как слабую двухосновную кислоту, которая характеризуется двумя константами ионизации Ка1 и Ка2 (или р Ка1 = 2,6 и Ка2 = 9,8). Следовательно, должно существовать два вида глициновых буферных растворов.
В водных растворах глицина все его три формы (R +, R , R‾ ) находятся в подвижном равновесии. Это равновесие при подкислении должно сдвигаться в сторону увеличения концентрации R+. Следовательно при добавлении к глицину определённого количества сильной кислоты получается смесь двух форм R+ и R± , которая представляет собой глициновый кислотный буферный раствор.
N +H3 – CH2 – COO ‾ + H+(недост.) ↔ NH3 + – CH2 – COOH
В этом случае катион глицина играет роль кислоты, а глицин – соли. Величина рН такого раствора вычисляется по формуле:
рН = рКа1 + lg[R±] / [R+]
При добавлении к глицину щелочи равновесие сдвигается в сторону увеличения концентрации R‾ . При этом можно получить смесь форм R± и R‾. Такая смесь представляет собой глициновый щелочной буферный раствор.
NH3+ - CH2 - COO‾ + OH ‾ (недост.) ↔ NH2 – CH2 – COO ‾
В этом случае роль кислоты играет биполярный ион глицина R±, а соли – анион глицина R‾. Величину рН такой буферной смеси вычисляют по формуле:
рН = рКа2 + lg[R±] / [R+]
Кислотно-основаное состояние организма
Кислотно-основное состояние – неотъемлемая составная часть гомеостаза внутренней среды организма, который обеспечивает оптимальные условия правильного течения обмена веществ.
Физиологические системы регуляции кислотно-основного состояния связаны с функциональной активностью лёгких и почек.
Процессы, происходящие в лёгких, связаны с тем, что образование оксигемоглобина приводит к освобождению иона водорода из гемоглобина. Ион водорода ассоциируется с бикарбонатом. Образующаяся в результате угольная кислота распадается в лёгких под действием фермента карбоангидразы, и удаление СО2 в атмосферу смещает равновесие этой реакции в сторону распада угольной кислоты. Ион водорода при этом оказывается в составе воды, - соединения, мало способного к диссоциации. В результате этих процессов идёт активное удаление гидрокарбонат-иона, потери которого восполняются его ресинтезом в почках.
Действие почек заключается в удалении из организма ионов водорода и насыщении плазмы крови гидрокарбонат-ионом. При этом принципиальную роль играет фермент карбоангидраза клеток канальцев почек, имеющая ту особенность, что быстро образует угольную кислоту и значительно более медленно её разлагает, вне зависимости от концентрации СО2 и воды.
Принципиальную роль играют биосинтез аммиака в почках и фосфатная буферная система мочи. В результате ферментативной реакции дезаминирования (отщепление аммиака) глутаминовой кислоты образуется аммиак, который связывает протоны, превращаясь в ион аммония. Процесс замены натрия на аммоний в дигидрофосфате приводит к изменению соотношения гидрофосфат/дигидрофосфат от 1 : 4 в крови до 1 : 50 в почках.
Способносмть почек выводить из организма ионы водорода настолько велика, что в итоге соотношение между концентрациями водородных ионов в моче и в крови может составить 800 : 1.
Рассмотренные буферные системы крови и физиологические механизмы в норме обеспечивают стабильное значение рН . Дисбаланс между образованием и удалением ионов водорода, когда вышеуказанные механизмы стабилизации не справляются с нагрузкой, приводит к снижению или повышению рН. В первом случае (снижение рН) состояние называется ацидозом. Во втором случае (при повышении рН) – алкалозом.
В зависимости от механизма развития расстройств кислотно-основного состояния выделяют дыхательный и метаболический ацидозы и алкалозы.
Метаболический ацидоз характеризуется нарушением метаболизма, которое приводит к нескомпенсированному или частично компенсированому падению рН крови.
Метаболический ацидоз наступает вследствие:
а) избыточного введения или образования стойких кислот (поступление кетокислот при голодании и диабете, повышеное образование молочной кислоты при шоке, повышенное образование серной кислоты при усиленном катаболизме, то есть в процессе распада биомолекул, и др.);
б) неполного удаления кислот при почечной недостаточности;
в) избыточной потери гидрокарбонат-иона в результате поноса, колита, язвы кишечника. Процессы компенсации связаны с нейтрализацией ионов водорода гидрокарбонат-ионом и усилением лёгочной вентиляции.
Метаболический алкалоз характеризуется нарушением метаболизма, которое приводит к нескомпенсируемому или частично компенсируемому увеличению рН крови.
Метаболический алкалоз наступает вследствие:
а) потери водородных ионов (высокая кишечная непроходимость, рвота и др.);
б) увеличение концентрации гидрокарбоната (потеря воды, избыточное введение гидрокарбонат-ионов при метаболическом ацидозе, введение солей органических кислот – молочной, уксусной, лимонной, метаболизирующих с поглощением ионов водорода и др.).
Компенсации этого явления достигают снижения лёгочной вентиляции (задержка СО2), удалением гидрокарбонат-иона почками.
Дыхательный ацидоз – это нескомпенсированное или частично компенсированное снижение рН в результате гиповентиляции из-за:
а) заболевания лёгких или дыхательных путей (пневмония, отёк лёгких, инородные тела в верхних дыхательных путях и т.д.); б) повреждения (заболевания) дыхательной мускулатуры; в) угнетении дыхательного центра лекарственными средствами или наркотиками – опиатами, барбитуратами и т.п.
Дыхательный алкалоз – это нескомпенсированное или частично компенсированное повышение рН в результате гипервентиляции из-за лихорадочного состояния или истерии. Процессы компенсации осуществляются буферными системами, повышенным выведением гидрокарбонат-иона почками.
Для коррекции кислотно-щелочного равновесия при ацидозах обычно используют 4% раствор гидрокарбоната натри, который вводят внутривенно. Коррекция кислотно-щелочного равновесия при алкалозах более слона. В качестве одной из временных мер целесообразно введение 5% аскорбиновой кислоты.
ЛЕКЦИЯ № 3. КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ
Некоторые физические свойства разбавленных растворов зависят от числа растворённых частиц в растворе, а не от химического состава раствора. Поскольку такие свойства обусловлены коллективным влиянием растворённых частиц, их принято называть коллигативными – от латинского colligatus, что означает собирать.
К ним относятся: диффузия и осмос, давление насыщенного пара растворителя и раствора, температура кристаллизации раствора, температура кипения раствора.
Диффузия
Диффузией называется свойство вещества равномерно распределяться по всему предоставленному ему объёму.
Скорость диффузии в газах велика, в твёрдых телах длится годами, в жидкостях протекает за десятки часов. Если к раствору в сосуде прилить чистый растворитель поверх раствора, то диффузия будет протекать в обоих направлениях: растворённое вещество будет диффундировать в растворитель, а растворитель в раствор. Это приведёт к тому, что концентрация растворённого вещества станет одинаковой во всём объёме системы. Количество вещества, переносимое за счёт диффузии в единицу времени, имеет прямую зависимость от температуры, от величины разности концентраций, от площади поверхности, через которую осуществляется диффузия. В то же время скорость диффузии обратно пропорциональна вязкости среды и разнице частиц в единице объёма.
ОСМОС
Иная картина наблюдается в тех случаях, когда отдельные части системы разделены перегородками, которые пропускают одни компоненты (например, молекулы растворителя) и непроницаемы для других (например, для молекул растворённого вещества). Простыми и давно известными примерами таких перегородок, называемых полупроницаемыми, является кожа, плавательный пузырь рыбы, растительный пергамент, животные и растительные ткани и т.д.
Если сосуд 1, сделанный из пористого материала, способного пропускать только молекулы воды и неспособного пропускать молекулы растворённого вещества, заполнить раствором какого-либо вещества с концентрацией его равной с1 и поместить в сосуд 2, содержащий раствор этого же вещества с меньшей концентрацией с2, то процесс выравнивания концентраций растворов возможен, но механизм процесса будет другим. Молекулы воды будут проходить через полупроницаемую перегородку в сосуд 1, так как концентрация вещества с1 > с2. Этот процесс способствует выравниванию концентраций растворённого вещества в сосудах 1 и 2. Растворитель из разбавленного раствора переходит в концентрированный, который при этом разбавляется. Процесс идёт в сторону выравнивания концентраций.
Самопроизвольный переход воды (растворителя) через полупроницаемую перегородку в раствор называется осмосом.
Иначе говоря, осмос это односторонняя диффузия растворителя через полупроницаемую перегородку в раствор какого-либо вещества. Молекулы растворённого вещества переходить через полупроницаемую перегородку не могут.
Осмотическое давление и его измерение
Прибор, применяемый для количественного изучения осмоса, называется осмометром. Простейший осмометр представляет собой сосуд 1, дно которого является полупроницаемой перегородкой. К сосуду приварен тонкий капилляр. Сосуд 1 содержит разбавленный раствор сахара. Полупрницаемая перегородка (дно сосуда 1) может пропускать только молекулы воды (но не молекулы сахара!). Если сосуд 1 опустить в стакан 2, заполненный водой, то молекулы воды будут диффундировать в сосуд 1, где концентрация молекул воды меньше, чем в стакане 2.
Сила (на единицу площади), заставляющая растворитель переходить через полупроницаемую перегородку в раствор (находящийся при том же внешнем давлении, что и растворитель), называется осмотическим давлением.
В следствии осмоса уровень раствора в сосуде 1 повышается,
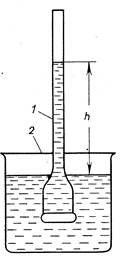 |
Рис….Простейший прибор для измерения осмотического давления: 1 – внутренний стакан; 2 – внешний стакан.
В следствии осмоса уровень раствора в сосуде 1 повышается, создавая дополнительное давление, которое препятствует осмосу. При некоторой высоте h столба жидкости в сосуде 1 дополнительное давление достигает такой величины, при которой осмос прекращается. Устанавливается равновесие между раствором данной концентрации и чистым растворителем, разделёнными полупроницаемой перегородкой. Увеличивая извне давление в сосуде 1, можно заставить воду переходить из сосуда 1 во внешний сосуд 2. При этом концентрация раствора в сосуде 1 будет возрастать до тех пор, пока не достигнет значения, соответствующего увеличенному давлению; установится новое равновесие между раствором и растворителем.
Таким образом,
равновесию между раствором заданной концентрации и чистым растворителем, разделёнными полупроницаемой перегородкой, соответствует определённое гидростатическое давление в сосуде с раствором.
Гидростатическое давление, равное высоте h, препятствующее односторонней диффузии растворителя, численно равно осмотическому давлению πосм раствора.
В 1887 г ботаник Пфеффер экспериментально установил две закономерности, которым подчиняется осмотическое давление неэлектролита.
1. В разбавленных растворах неэлектролита при данной температуре осмотическое давление прямо пропорционально концентрации
πосм = К1С
2. При одной и той же концентрации С (моль/л) осмотическое давление разбавленного раствора прямо пропорционально абсолютной температуре
πосм= К2С
Вант-Гофф обратил внимание на аналогию между законами Пфеффера и газовыми законами Гей-Люссака и Бойля-Мариотта. Анализируя числовые данные, он пришел к выводу, что величину осмотического давления можно вычислять по следующей формуле:
πосм = СRT,
где С – концентрация вещества в растворе, R – универсальная газовая постоянная, Т – абсолютная температура.
Это выражение носит название закона Вант-Гоффа для осмотического давления. Приведём формулировку закона, данную Вант-Гоффом:
Осмотическое давление разбавленного раствора неэлектролита равно тому давлению, которое производило бы растворённое вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало объём, равный объёму раствора.
Однако, несмотря на сходство с уравнением состояния идеальных газов, аналогия между осмотическим и газовым давлением случайна.
В биологических жидкостях (моча, плазма, слюна, молоко и др.) в больших количествах содержатся неорганические и органические вещества в виде молекул, ионов и коллоидных частиц. Их суммарная концентрация носит название осмотической концентрации (или осмолярности). и именно эта величина должна быть использована в уравнении Вант-Гоффа.
Осмолярная концентрация – суммарное молярное количество всех кинетически активных, т.е.э способных к самостоятельному движению, частиц, содержащихся в 1 литре раствора, независимо от их формы, размера и природы.
Осмолярная концентрация раствора связана с его молярной концентрацией через изотонический коэффициент cосм =ic(x). Это очень важно учитывать при приготовлении физиологических растворов. Осмотические свойства тканей следует учитывать также и в медицине при внутривенных вливаниях лекарств. Вводимый раствор не должен быть токсичным, а кроме того, необходимо, чтобы его осмотическое давление было таким же, как у кровяной плазмы, иначе говоря, вводимый раствор должен иметь такое же осмотическое давление. Например, так называемый физиологический раствор, который можно вводить человеку внутривенно в больших количествах, является изотоническим раствором хлорида натрия. При приготовлении физиологических растворов необходимо учитывать их осмотические свойства.
Роль осмотических явлений в различных физиологических процессах чрезвычайно велика. Постоянство осмотического давления (изоосмия) тех или иных физиологических сред (плазма, внутриклеточная жидкость, моча и т.д.) представляют собой фундаментальное физико-химическое требование гомеостаза. Осмотическое давление плазмы крови человека составляет около 8 атмосфер, у рыб ≈ 15, у отдельных растений может достигать 100, а у прорастающих семян – до 400 атмосфер. Столь высокие значения осмортического давления достигаются за счёт суммарного эффекта растворённых неорганических веществ. В плазме наиболее значимым компонентом является NaCl.
На долю ВМС – белков – приходится незначительная часть от общего давления, называемая онкотическим давлением. Величина онкотического давления крови, вызываемого альбуминами и глобулинами, составляет 0,03 – 0,04 атм. Однако эта незначительная составляющая от общего осмотического давления играет принципиальную роль в некоторых физиологических процессах.
Осмотический метод применим также для определения молекулярной массы высокомолекулярных соединений. Зависимость осмотического давления растворённого вещества от его концентрации описывается соотношением
πосм= gRT/M + A∙g2
или
πосм/g = RT/M + A∙g
где g – масса вещества в граммах, М – молярная масса полимера.
Для электролитов, в растворах которых при диссоциации молекул увеличивается число частиц, Вант-Гофф предложил использовать изотонический коэффициент i, который учитывает изменение числа частиц в растворе. Физический смысл этого коэффициента следующий:
i = число всех частиц в растворе/число исходных частиц
Для растворов неэлектролитов i = 1, а для растворов электролитов вследствие диссоциации их молекул i > 1:
Электролит NaCl CaCl2 Na3PO4
I(максим.) = 2 3 4
Если в растворе идёт процесс ассоциации частиц, то i < 1.
Для растворов электролитов формулу Вант-Гоффа записывают так: πосм= iCRT.
Если у двух растворов осмотическое давление одинаковое, то эти растворы называются изотоническими и между ними происходит подлинно равновесный обмен молекулами растворителя.
Если в контакте два раствора с разными πосм , то раствор с большим πосм называют гипертоническим, а с меньшим πосм - называют гипотоничсеским. Гипертонический раствор будет всасывать растворитель из гипотонического вследствие стремления к выравниванию концентрации веществ за счёт перераспределения растворителя между этими растворами.
Осмотическая ячейка – это система, отделённая от окружающей среды мембраной с избирательной проницаемостью. Все клетки живых существ – осмотические ячейки.
Явление движения растворителя из окружающей среды в осмотическую ячейку называют эндосмосом.
Условия эндосмоса: Свнутр. > Снаруж.; πосм(внутр.) > πосм(наруж.).
В результате эндосмоса вода диффундирует в клетку, происходит набухание клетки с появлением напряженного состояния клетки, называемого тургор. В растительном мире тургор помогает растению сохранять вертикальное положение и определённую форму.
Если разница в концентрациях наружного и внутреннего раствора достаточно велика, а прочность оболочки клетки небольшая, то эндосмос приводит к разрушению клеточной мембраны и лизису клетки. (Напомним, что лизис это разрушение, распад, растворение клеток).
Эндосмос является причиной гемолиза (гематолиза) – разрушения эритороцитов крови с выделением в окружающую среду гемоглобина. В норме гемолиз завершает жизненный цикл эритроцитов (приблизительно 125 суток) и происходит в организме человека и животных непрерывно. Патологический гемолиз происходит под влиянием гемолитических ядов, холода, некоторых лекарственных веществ и других факторов.
Кроме эндосмоса возможен экзосмос:
экзосмос – это движение растворителя из осмотической ячейки в окружающую среду.
Условия экзосмоса: Снаруж.> Свнутр.; πосм(наруж.) > πосм(внутр.).
В результате экзосмоса вода диффундирует из клетки в плазму и происходит сжатие и сморщивание оболочки клетки, называемое плазмолизом. Экзосмос имеет место, если клетка оказывается в гипертонической среде. Явление экзосмоса наблюдается, например, при посыпании ягод или фруктов сахаром, а овощей, мяса, рыбы – солью. При этом происходит консервирование продуктов питания благодаря уничтожению микроорганизмов вследствии их плазмолиза.
Любое нарушение осмотического давления в тканях вызывает различные заболевания (так, например, отёки связаны с нарушением осморегуляции).
Временные нарушения осмотических свойств тканей вызывают различные физиологические ощущения. Например, чувство жажды, возникающее после приёма большого количества солёной пищи, связано с тем, что при этом возрастает содержание солей в клеточном соке организма. Потребность организма в воде для уменьшения осмотического давления тканевых растворов проявляется в виде чувства жажды. Известно, что в период сильной жары туристам и солдатам во время походов, а также рабочим горячих цехов дают солёное питьё (а ещё лучше поваренную соль). Этот, на первый взгляд, парадокс объясняется весьма просто. При сильной жаре с потом из организма удаляется значительное количество солей. Поскольку содержание солей в поте выше, чем в клеточном соке тканей человека, это приводит к нарушению осморегуляции, и осмотическое давление тканей становится ниже нормального. Однако организм на любое отклонение (как на повышение, так и на понижение осмотического давления) отвечает одинаковой реакцией – чувством жажды. Человек пьёт воду, но она только усиливает жажду. Чтобы избавиться от жажды, надо увеличить осмотическое давление тканей, то есть ввести в них не воду, а дополнительное количество солей.
Основную задачу осморегуляции выполняют почки. Осмотическое давление мочи в норме значительно выше, чем плазмы крови, что обеспечивает активный транспорт из крови в почку. Осморегуляция осуществляется под контролем ферментативных счистем. Нарушение их деятельности приводит к патологическим процессам. Так, например, при нефрите осмотическое давление у мочи может оказаться ниже, чем у крови, что вызовет обратный транспорт веществ.
ПОНИЖЕНИЕ ДАВЛЕНИЯ ПАРА РАСТВОРОВ.
Представим себе, что мы имеем сосуд с каким-либо растворителем (жидкостью). Площадь поверхности сосуда равна S. Над сосудом устанавливается определённое давление пара данной жидкости. Это давление характеризует состояние равновесия между жидкой фазой и находящимися над ней молекулами растворителя.
Введём в растворитель нелетучее вещество, концентрация которого в растворе будет ничтожно малой, т.е. такой величиной, которой можно пренебречь. Давление пара такого раствора будет меньше давления паров растворителя при такой же температуре. Понижение давления объясняется тем, что часть площади поверхности раствора, в отличие от площади поверхности чистого растворителя, занята молекулами нелетучего растворённого вещества. Поэтому число молекул растворителя испаряющихся в единицу времени уменьшается. Число же молекул растворителя, переходящих из газовой фазы в раствор остаётся без изменения, поскольку общая площадь поверхности сосуда остаётся прежней, равной S.
Кроме того, силы сольватации между молекулами растворителя и растворённого вещества больше, чем силы сцепления между молекулами растворителя. Это тоже способствует тому, что уменьшается число молекул растворителя, испаряющихся из раствора.
Отсюда ясно, что в новых условиях устанавливается новое равновесие между раствором и газовой фазой, в этих условиях давление пара раствора будет несколько меньше давления пара растворителя при той же температуре.
Обозначим давление насыщенного пара чистого растворителя при данной температуре через Р0, а давление насыщенного пара растворителя над раствором раствора через Р, тогда разность Р0 – Р = ΔР покажет величину понижения парциального давления пара над разбавленным бинарным раствором неэлектролита. Отнеся эту разность к давлению пара растворителя, получим так называемое относительное понижение давления пара растворителя:
Р0 – Р/Р0
Согласно I-му закону Рауля,
относительное понижение парциального давления парарастворителянад разбавленным раствором неэлектролита равно мольной доле растворённого вещества:
pо – р/ро = х2или, так как х1 + х2 = 1, р1 = р0х1
где х1 и х2 – соответственно мольные доли растворителя и растворённого вещества. (Напомним, что мольная доля растворённого вещества – это отношение количества растворённого вещества к общему количеству растворённого вещества и растворителя).
Температуры кипения и отвердевания растворов
Из первого закона Рауля вытекает, что растворы нелетучих веществ должны кипеть при более высокой температуре и отвердевать при более низкой по сравнению с чистым растворителем.
При нагревании жидкости давление насыщенного пара увеличивается. Жидкость кипит тогда, когда давление насыщенного пара становится равным внешнему давлению. Температура кипения жидкости – это температура, при которой давление насыщенного пара над жидкостью равно внешнему давлению.
Из-за понижения давления пара раствора последний должен быть нагрет до более высокой температуры, чем растворитель. В этом случае давление пара раствора достигнет внешнего давления и раствор закипит. Чем выше концентрация раствора, тем выше температура его кипения.
Любое чистое вещество, находящееся в жидком состоянии, характеризуется определённой температурой замерзания, при которой оно полностью отвердевает. Температурой начала кристаллизации раствора называется температура, при которой при охлаждении начинается образование кристаллов. Температуру начала кристаллизации принято называть температурой замерзания в тех случаях, когда эта температура ниже комнатной.
При замерзании давление насыщенного пара над твёрдым веществом и над жидкостью одинаково.
Второй закон Рауля формулируется иак:
повышение температуры кипения или понижение температуры отвердевания разбавленных растворов неэлектролитов пропорциональны числу частиц растворённого вещества и не зависят от его природы.
Математически это выражается следующими формулами:
ΔТкип = Еb и ΔТзам = Кb
где Е и К – коэффициенты пропорциональности, соответственно эбуллиоскопическая и криоскопическая константы, зависящие только от природы растворителя, для воды К=1,86, Е=0,516, а b – моляльность раствора. (Напомним, что моляльность раствора – это количество растворённого вещества, приходящееся на 1 кг растворителя.).
Законы Рауля находят важное практическое применение. Одно из них – возможность определять молекулярные массы растворённых веществ.
1. Учитывая определение мольной доли и обозначая через х1 и х2 соответственно число молей растворителя и число молей растворённого вещества можно записать следующее:
Р0 – Р/Р0 = х2 = х2/х1 + х2
Если раствор состоит из g1 граммов растворителя с молярной массой М1 и g2 граммов вещества с молярной массой М2, то получаем
x1 = g1/M1 и х2 = g2/M2
Учитывая полученные формулы, приведённое уравнение принимает вид
Р0 – Р/Р0 = g2/M2/ (g1/M1) + (g2/M2).
Поскольку раствор разбавлен, число молей х2 мало по сравнению с х1. Поэтому можно упростить полученное выражение:
Р0 – Р/Р0 = х2/x1 = g2M2 / g1M1.
Физические константы Р0 и М1 растворителя известны (они приводятся в справочниках), массы g1 и g2 определяются при приготовлении раствора. Чтобы вычислить неизвестную молярную массу М2 какого-либо вещества, остаётся измерить давление пара раствора Р (точнее уменьшение давления пара Р0 – Р).
2. Зная, что моляльным повышением температуры кипения, или эбуллиоскопической константой Е, называется повышение температуры кипения, которое происходит при растворении 1 моля вещества в 1000 г растворителя, можно определять неизвестные молярные массы различных веществ.
Так, например, если известны эбуллиоскопическая константа растворителя и повышение температуры кипения раствора ΔТкип= Т – Т0 (где Т – температура кипени раствора, Т0 – температура кипения растворителя), то можно определить молярную массу М2 растворённого вещества, используя формулу:
ΔТкип= Е ∙ 1000∙g2 / M2∙ g1 или M2 = E ∙ 1000∙g2 / ΔТкип ∙g1
Эбуллиоскопический метод определения молекулярной массы применяется для веществ, которые не могут быть превращены в пар и для которых, следовательно, нельзя использовать метод плотности пара.
3. Зная, что молярным понижением температурыплавления, или криоскопической константой Кзам, называется понижение температуры замерзания раствора, обусловленное 1 молем вещества, растворённого в 1000 г растворителя, можно определять неизвестные молярные массы веществ. Для этого используют следующие формулы:
ΔТзам = Кзам ∙ 1000∙g2 / M2∙g1 или M2 = Kзам ∙ 1000∙g2 / ΔТзам ∙g1
(формулы получены с помощью рассуждений, аналогичных вышеприведённым).
Криоскопический метод определения молярных масс широко применяется в химической практике, особенно в органической химии.
Дата добавления: 2015-11-20; просмотров: 6809;
