Лекция 7. Химическое равновесие.
Обратимые и необратимые реакции. Химическое равновесие. Константа химического равновесия. Принцип Ле-Шателье.
Обратимые и необратимые реакции. Химическое равновесие.
Все химические реакции разделяют на две группы: обратимые и необратимые. Когда при химическом взаимодействии хотя бы одно из веществ расходуется полностью, реакция считается необратимой. Она протекает до конца. К необратимым относят реакции между веществами, в результате которых образуются осадки, газы, и малодиссоциирующие вещества.
Обратимые реакции протекают не до конца. В них ни одно из реагирующих веществ не расходуется полностью. Необратимая реакция может протекать только в одном направлении. Обратимая реакция может протекать как в прямом, так и в обратном направлении.
Примером необратимой реакции является взаимодействие цинка с концентрированной азотной кислотой
Zn + 4HNO3 → Zn(NO3)2 + 2NO2↑ + 2H2O (1).
Данная реакция не может протекать в обратном направлении. Примером обратимой реакции является синтез аммиака
N2 +3H2 ↔ 2NH3 (2).
Реакция может протекать как в прямом так и в обратном направлении. Реакцию, протекающую слева направо, называют прямой, а протекающей справа налево – обратной.Если в системе скорость прямой реакции  пр равна скорости обратной реакции
пр равна скорости обратной реакции 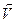 обр, то такое состояние называется химическим равновесием.На рис. 1 показано изменение скоростей прямой (
обр, то такое состояние называется химическим равновесием.На рис. 1 показано изменение скоростей прямой (  пр) и обратной (
пр) и обратной ( 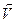 обр) реакции. В случае реакции (2) химическое равновесие устанавливается между азотом, водородом и аммиаком. Химическое равновесие – это динамическое равновесие.
обр) реакции. В случае реакции (2) химическое равновесие устанавливается между азотом, водородом и аммиаком. Химическое равновесие – это динамическое равновесие.

Рис. 1. Химическое равновесие: равенство скоростей прямой и обратной реакций.
Таким образом, кинетическим условием химического равновесия является равенство скоростей прямой и обратной реакции:
 пр=
пр= 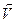 обр (3).
обр (3).
Константа равновесия.
Количественной характеристикой химического равновесия является константа химического равновесия. Величина, равная отношению произведения равновесных концентраций продуктов реакций к произведению равновесных концентраций исходных веществ в степенях их стехиометрических коэффициентов, называется константой равновесия химической реакции (обозначается через Кс). Для реакции
аА + вВ = сС + dD (4)
константа равновесия записывается в виде выражения
Kc = 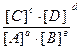 (5)
(5)
где [ ] – равновесные концентрации.
Для реакции
Н2 (г) + I2 (г) = 2НI (г) (6)
константа равновесия равна
Кс =  (7).
(7).
Согласно закону действующих масс
 пр = К1 С(Н2) ∙ С(I2)
пр = К1 С(Н2) ∙ С(I2)
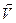 обр = К2С2 (НI),
обр = К2С2 (НI),
где С(Н2), С(I2) – концентрации водорода и иода в текущий момент времени.
При равновесии
 пр=
пр= 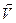 обр
обр
С(Н2) = [Н2]
С(I2) = [ I2]
С(НI) = [НI].
Используя данные равенства, получаем
К1[Н2] ·[ I2] = К2[НI]2
или
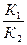 =
=  .
.
Таким образом, отношение констант скорости прямой и обратной реакции – есть константа равновесия, то есть
К1/К2 = Кс (8).
Поэтому константа равновесия Кс - есть постоянная величина, показывающая то соотношение между концентрациями продуктов реакции (числитель) и их веществ (знаменатель), которые устанавливаются при равновесии и при условии постоянства температуры. Численное значение Кс характеризует выход данной реакции. Выход реакции называется отношение количества получаемого вещества к тому его количеству, которое получилось бы при протекании реакции до конца. Если К > 1, то выход реакции велик, реакция смещена сильно вправо.
Уравнение константы равновесия (5) показывает, что в условиях равновесия концентрации всех веществ, участвующих в реакции, связаны между собой. Изменение концентрации любого из веществ – участников реакции, влечёт за собой изменения концентраций всех остальных веществ.
Константа равновесия так же, как и константы скоростей К1 и К2, зависят от природы реагентов, температуры и не зависит от исходных концентраций в системе. От присутствия катализатора константа равновесия Кс не зависит, так как катализатор изменяет энергию активации и прямой и обратной реакции на одну и ту же величину, но на их отношение К1/К2 он не оказывает влияния.
Концентрации газообразных веществ в (5) могут быть заменены равновесными парциальными давлениями этих веществ
Кр = 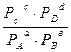 (9).
(9).
Если обратимая реакция протекает в гетерогенной системе, то Кр равна отношению равновесных парциальных давлений газообразных веществ и не зависит от количества веществ, находящихся в конденсированной фазе (твердой или жидкой).
Константа равновесия реакции связана со стандартным изменением энергии Гиббса выражением
∆Go = - RT lnКс (10)
или
Кс = ехр(-∆Go/RT) (11).
Данные выражения позволяют, зная ∆Go, вычислить Кс и наоборот по известному значению константы равновесия вычислить изменение энергии Гиббса.
Смещение химического равновесия. Принцип Ле-Шателье
Смещение химического равновесия может быть осуществлено как в сторону обратной реакции (влево), так и в сторону прямой реакции (вправо). На смещение химического равновесия влияют следующие факторы:
- изменение концентрации какого-либо из веществ, участвующих в реакции;
- изменение температуры;
- изменение давления.
Направление смещения химического равновесия определяется принципом Ле-Шателье. Он формулируется следующим образом:
Если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие реакции смещается в том направлении, которое ослабляет эффект внешнего воздействия.
По принципу Ле-Шателье, при изменении концентрации одного из участников реакции, равновесие сместиться в сторону, компенсирующую данное изменение. При повышении концентрации одного из исходных реагентов равновесие смещается в сторону прямой реакции (вправо), а при повышении концентрации одного из продуктов – в сторону обратной реакции (влево).
Если в обратимой реакции участвует хотя бы одно газообразное вещество, то смещение равновесия может быть вызвано изменением давления. При повышении давления (при постоянной температуре) происходит сжатие газа и повышение его концентрации. Поэтому равновесие смещается в направлении понижения концентрации газообразного компонента. Для реакции
А(г) + 2В(г) = С + D(г).
повышение давления приводит к смещению равновесия в сторону понижения концентрации газа, то есть в сторону образования газообразного продукта. При понижении давления реакция смещается в сторону повышения концентрации исходных газообразных реагентов.
Согласно принципу Ле-Шателье повышение температуры вызывает смещение равновесия в направлении того из процессов, течение которого сопровождается поглощением теплоты, а понижение температуры действует в противоположном направлении.
Так при повышении температуры равновесие экзотермической реакции (реакции, идущей с выделением теплоты, ∆Нто < 0) смещается в сторону обратной реакции, поскольку прямая реакция идёт с выделением тепла.
В случае эндотермической реакции (реакции, идущей с поглощением тепла,
∆Нто > 0), при повышении температуры равновесие смещается в сторону прямой реакции.
Изучение химического равновесия имеет большое значение. Определяя положение равновесия для различных температур и давлений, можно выбрать наиболее благоприятные условия проведения химического процесса. Подобрать такие условия осуществления химического равновесия, которые обеспечивают наибольший выход продуктов реакции при максимальной скорости его образования.
Дата добавления: 2015-08-08; просмотров: 1846;
