КЛАССИФИКАЦИЯ ФЕРМЕНТОВ
Современная номенклатура ферментов допускает старые тривиальные названия (папаин, пепсин, трипсин, цитохромы) и названия по рациональной номенклатуре, согласно которой название фермента составляется из названия субстрата и окончания –аза (амилаза, липаза, протеаза). По научной номенклатуре название фермента составляют из химического названия субстрата, акцептора и названия той реакции, которая осуществляется ферментом, например, L-аланин:2-оксоглутарат аминотрансфераза.
Существует Международная классификация ферментов. Согласно ей все ферменты включены в «Каталог ферментов» под своим классификационным номером, состоящим из четырех цифр. Первая цифра указывает на принадлежность к одному из шести главных классов. Следующие две определяют подкласс и подподкласс, а последняя цифра – номер фермента в данном подподклассе. Например, лактатдегидрогеназа имеет номер КФ 1.1.1.27.
В основу классификации ферментов положен тип реакций, подвергающихся каталитическому воздействию. Классы ферментов:
1. Оксидоредуктазы – катализируют окислительно-восстановительные реакции.
2. Трансферазы – переносят ту или иную функциональную группу от одного субстрата на другой.
3. Гидролазы – также участвуют в переносе групп, однако акцептором всегда является молекула воды.
4. Лиазы (синтазы) – катализируют расщепление или образование химических соединений или образование химических связей, при этом образуются или исчезают двойные связи.
5. Изомеразы – перемещают группы в пределах одной молекулы.
6. Лигазы (синтетазы) – катализируют энергозависимые реакции присоединения и поэтому их действие сопряжено с гидролизом АТФ.
Оксидоредуктазы катализируют реакции, имеющие общий вид:
BH2 + A ↔ B + AH2
Характерной особенностью деятельности оксидоредуктаз в клетке является их способность образовывать системы окислительно-восстановительных ферментов, в которых осуществляется многоступенчатый перенос атомов водорода от первичного субстрата к конечному акцептору, обычно кислороду, с образованием воды.
Оксидоредуктазы, которые переносят протоны и электроны непосредственно на кислород, называются аэробными дегидрогеназами или оксидазами. Оксидоредуктазы, переносящие протоны и электроны от одного компонента окислительной цепи к другому без передачи на кислород, называются анаэробными дегидрогеназами или редуктазами.
Если фермент катализирует реакцию отнятия атомов водорода непосредственно от первичного субстрата, то его называют первичной дегидрогеназой.
Если фермент ускоряет снятие атомов водорода со вторичного субстрата, который сам ранее получил атомы водорода при помощи первичной дегидрогеназы, то его называют вторичной дегидрогеназой.
Другая особенность оксидоредуктаз состоит в том, что они ускоряют протекание химических процессов, связанных с высвобождением энергии.
Третья особенность оксидоредуктаз заключается в том, что имея несколько коферментов, они способны ускорять большое количество разных окислительно-восстановительных реакций. Один и тот же кофермент способен соединяться со многими апоферментами, образуя каждый раз оксидоредуктазу, специфичную по отношению определенному субстрату.
Самыми распространенными являются оксидоредуктазы, содержащие в качестве активной группы никотинамидадениндинуклеотид (НАД+) – производное никотинамида, витамина РР.
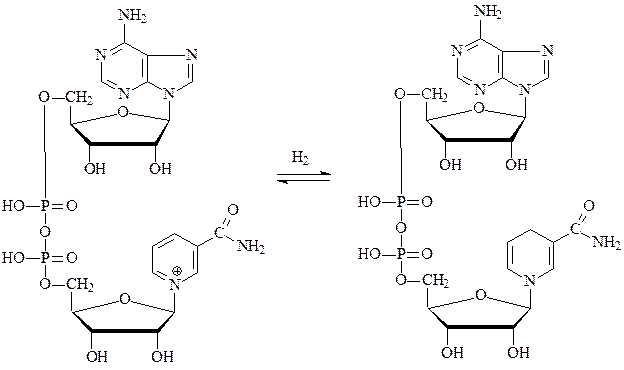
окисленная форма НАД+ восстановленная форма НАДН+Н
Субстратами НАД-зависимых дегидрогеназ являются спирты, альдегиды, амины, дикарбоновые и кетокислоты. Все НАД-зависимые дегидрогеназы являются анаэробными дегидрогеназами, то есть посылают атомы водорода на ближайший в окислительной цепи другой фермент.
Примером НАД-зависимой дегидрогеназы является алкогольдегидрогеназа из печени животных. Фермент состоит из двух субъединиц, каждая из которых несет молекулу НАД+ и атом Zn. Он катализирует реакцию окисления спирта в альдегид:
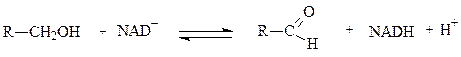
спирт альдегид
Кроме НАД+ оксидоредуктазы содержат в качестве кофермента НАДФ+, у которого водород ОН-группы 2-го углеродного атома рибозы аденозина замещен на остаток фосфорной кислоты.
Партнером НАД-зависимых дегидрогеназ выступают флавопротеиды, например флавинмононуклеотид ФМН, производное витамина В2. Окисленная форма ФМН окрашена, она способна принимать два протона и два электрона, переходя в лейкоформу:
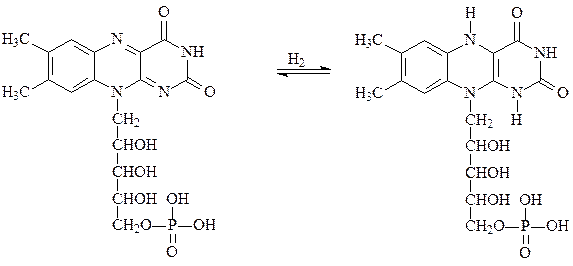
окисленная окрашенная форма ФМН восстановленная бесцветная форма ФМНН2
Другим коферментом во флавопротеинах является ФАД:
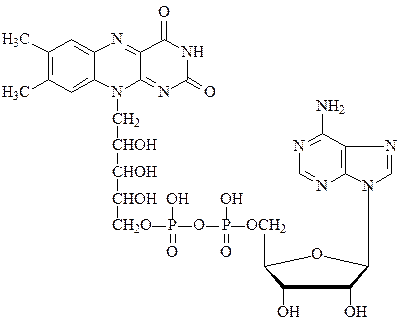
флавинадениндинуклеотид ФАД
Флавопротеины в большинстве случаев являются вторичными дегидрогеназами, однако некоторые флавопротеины, особенно с ФАД, могут непосредственно снимать атомы водорода с субстрата. Примером реакции с участием ФАД является окисление глюкозы глюкозооксидазой в глюконо-лактон. Глюкозооксидаза синтезируется плесневелыми грибами при рН 5–7. Фермент содержит две молекулы ФАД, высоко специфичен и стабилен. Применяют для получения D-глюконата кальция и удаления О2 из продуктов.
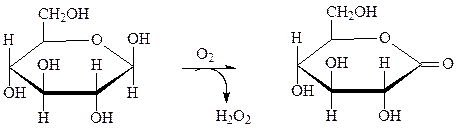
глюкоза глюкоза-6-фосфат
Коферментами оксидоредуктаз также являются хиноны – убихинон дыхательной цепи, пластохинон фотосинтезирующей системы хлоропластов. Они передают атомы водорода по окислительно-восстановительным цепям:
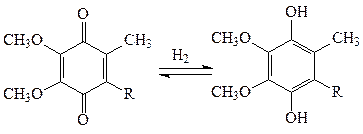
хинон гидроксихинон
Несколько оксидоредуктаз образуют цитохромную систему, имеющую в качестве простетических групп железопорфирины (геминовое железо). Они отличаются белковой частью. Обозначаются буквами a, b, c и d с индексами. Цитохромная система способна принимать электроны, снятые с восста-новленного убихинона. Она передает электроны далее по цепи цитохромов, в конце концов соединяя их с кислородом.
Трансферазы – один из наиболее обширных классов, специализи-руются на переносе функциональных групп с одного субстрата к другому. Делятся на подклассы в зависимости от характера переносимых групп.
Фосфотрансферазы – ускоряют реакцию переноса остатка фосфорной кислоты. Реакцией фосфорилирования обеспечивается превращение ряда органических соединений в фосфорные эфиры, обладающие повышенной химической активностью и более легко вступающие в последующие реакции. Перенос фосфатных групп идет на спиртовые, карбоксильные, азотсодержащие, фосфорсодержащие и другие группы. Донором фосфатных остатков является в большинстве случаев АТФ. Фосфотрансферазы, переносящие остаток фосфата с АТФ на белки, называются протеинкиназами. Они переносят фосфат на радикалы серина, треонина, тирозина, лизина и гистидина, в результате чего резко изменяется биологисческая активность ряда белков. Фосфотрансферазой является, например, гексокиназа – фермент, ускоряющий перенос остатка фосфорной кислоты от молекулы АТФ к глюкозе с образованием глюкозо-6-фосфата. Гексокиназа состоит из 4 субъединиц, каждая отдельная молекула лишена фосфотрансферазной активности. Обнаружено 5 изозимов гексокиназы:
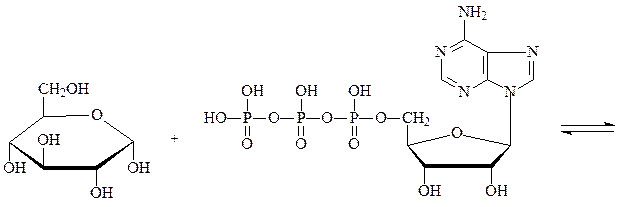 глюкоза АТФ
глюкоза АТФ
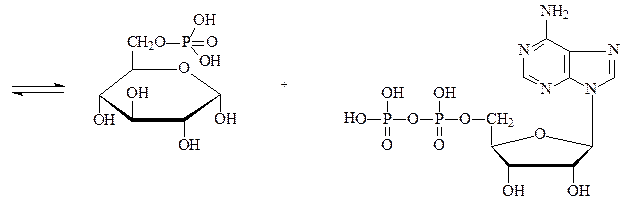
глюкозо-6-фосфат АДФ
Ацилтрансферазы – ускоряют перенос ацилов (остатков карбоновых кислот) на аминокислоты, амины, спирты и другие соединения. Универсальным источником ацильных групп во всех этих реакциях является ацилкоэнзим А (ацил-СоА), чаще всего переносу подвергается ацетил. Одним из примеров реакции трансацилирования является синтез ацетилхолина холинацетилтрансферазой:
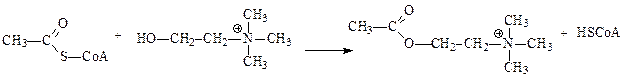
ацетил-СоА холин ацетилхолин СоА
Аминотрансферазы – ускоряют реакцию трансаминирования аминокислот с кетокислотами и очень важны для обеспечения биосинтеза аминокислот. Простетической группой аминотрансфераз является пиридоксальфосфат, производное витамина В6 (пиридоксина). Механизм реакции трансаминирования хорошо изучен. Ниже приведено суммарное уравнение и механизм реакции трансаминирования аланина с помощью фермента аланинаминотрансферазы (АЛТ).
Аланин + α-кетоглутарат ↔ пируват + глутамат.
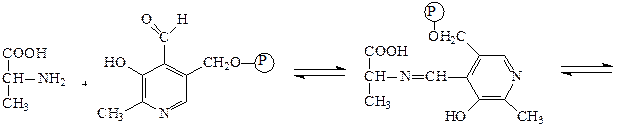
аланин пиридоксальфосфат основание Шиффа
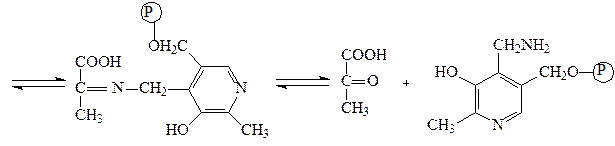
пируват пиридоксаминфосфат
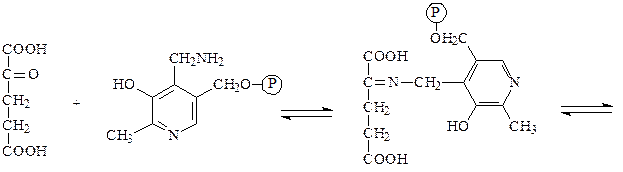
α-кетоглутарат пиридоксаминфосфат основание Шиффа
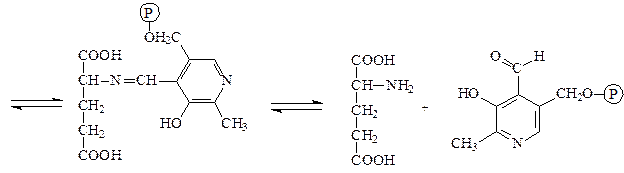
глутамат пиридоксальфосфат
Важное значение среди трансфераз имеют ферменты, ускоряющие перенос одноуглеродных фрагментов, содержащие в качестве коферментов фолиевую кислоту и цианокобаламин.
Гликозилтрансферазы – ускоряют реакции переноса гликозильных остатков из молекул фосфорных эфиров или других соединений к молекулам моносахаридов, полисахаридов или других веществ. Примером может служить фермент УДФ-глюкоза:гликоген-4-α-глюкозилтрансфераза, который осуществляет наращивание молекул гликогена на один остаток глюкозы:
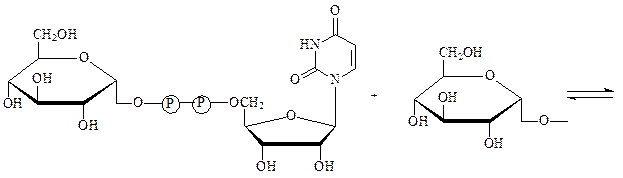
УДФ-глюкоза нередуцирующий конец
молекулы гликогена
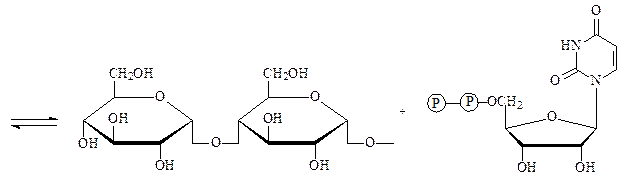
увеличенный на один остаток глюкозы УДФ
нередуцирующий конец молекулы гликогена
Гидролазы– самая распространенная группа ферментов, не содержат коферментов, то есть являются по химической структуре простыми белками. В зависимости от характера гидролизуемого субстрата гидролазы делятся на ряд подклассов.
Эстеразы – катализируют реакции гидролиза сложных эфиров спиртов с органическими и неорганическими кислотами. Примером эстераз является липаза, которая ускоряет гидролиз сложноэфирных связей в молекулах жиров:

трипальмитилглицерин 2-монопальмитилглицерин пальмитат
Другим примером являются фосфатазы, катализирующие гидролиз фосфорных эфиров, например глюкозо-1-фосфатаза:
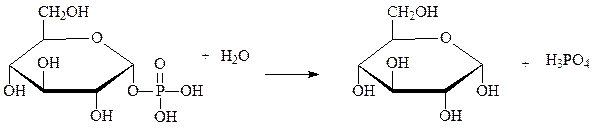
глюкозо-1-фосфат глюкоза
Гликозидазы – ускоряют реакцию гидролиза гликозидов. Обладают ярко выраженной пространственной специфичностью (α- и β-гликозидазы). Примером может служить сахараза, ускоряющая гидролиз сахарозы на глюкозу и фруктозу:
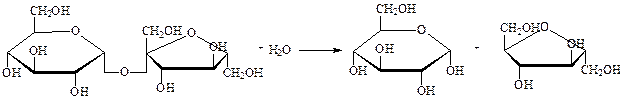
сахароза глюкоза фруктоза
Пептидазы – катализируют расщепление пептидных связей в белках и пептидах. Эндопептидазы катализируют гидролиз пептидных связей внутри молекулы, экзопептидазы – отщепление от полипептидной цепи концевых аминокислот (аминопептидазы и карбоксипептидазы). Существуют также дипептидазы, завершающие гидролиз белка. В зависимости от меха-низма действия эндопептидазы делятся на четыре подподкласса:
а) сериновые протеиназы, несут в активном центре остатки серина
и гистидина (трипсин, химотрипсин, субтилизин);
б) тиоловые тротеиназы, содержащие в активном центре цистеин (папаин,
фицин, бломелаин, катепсин В);
в) кислые протеиназы, имеющие оптимум рН ниже 5 и содержащие радикалы
дикарбоновых аминокислот в активном центре (пепсин, катепсин D);
г) металлопротеиназы, каталитическое действие которых зависит от ионов
металлов Са2+ и Zn2+ в активном центре (коллагеназа, термолизин).
Амидазы – ускоряют гидролиз амидов кислот. Из них важную роль играют уреаза, аспарагиназа и глутаминаза.
Уреаза была первым ферментом, полученным в кристаллическом виде. Это простой фермент, молекула его глобулярна и состоит из 8 одинаковых субъединиц. Уреаза обладает абсолютной специфичностью и ускоряет гидролиз мочевина до NH3 и СО2.
Аспарагиназа и глутаминаза ускоряют гидролиз амидов аспартата и глутамата, например:
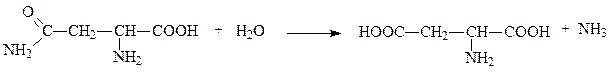
аспарагин аспартат
К гидролазам, действующим на C-N связи, относится аргиназа. Она обладает абсолютной специфичностью и гидролизует аминокислоту аргинин на орнитин и мочевину:

аргинин мочевина орнитин
Лиазы – ускоряют негидролитические реакции распада органических соединений по связям C-C, C-N, C-O, C-S. При этом замыкаются двойные связи и выделяются такие простейшие продукты, как CO2, H2O, NH3. Некоторые из этих реакций являются обратимыми, и соответствующие ферменты в подходящих условиях катализируют реакции не только распада, но и синтеза.
Одной из важнейших групп этого класса являются углерод-углерод-лиазы. К ним относятся декарбоксилазы кето- и α-аминокислот и альдегид-лиазы. Представителем альдегид-лиаз является альдолаза, катализирующая обратимую реакцию расщепления фруктозо-1,6-дифосфата до фосфотриоз:

фруктозо-1,6-дифосфат дигидроксиацетонфосфат глицеральдегид-3-фосфат
В качестве коферментов декарбоксилазы кетокислот используют производное витамина В1 – тиаминпирофосфат, а декарбоксилазы α-амино-кислот – пиридоксальфосфат. Например, пируватдекарбоксилаза и лизин-декарбоксилаза катализируют следующие две реакции соответсвенно:
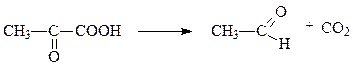
пируват ацетальдегид
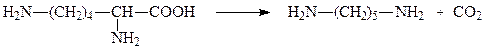
лизин кадаверин
Другой важной группой лиаз являются углерод-кислород-лиазы, ускоряющие реакции гидратирования и дегидратирования при метаболизме углеводов и жирных кислот. Например, фумарат-гидратаза катализирует присоединение воды по двойной связи фумарата с образованием малата:
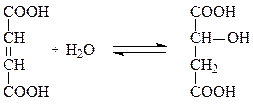
фумарат малат
Примером углерод-азот-лиаз может служить аспартат-аммиак-лиаза, ускоряющая реакцию прямого дезаминирования аспартата, фермент характерен для бактерий и ряда растений:
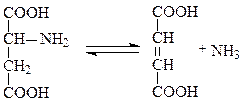
аспартат фумарат
Некоторые лиазы ускоряют реакции не только распада, но и синтеза. Например, из дрожжей выделен фермент L-серин-гидро-лиаза, отщепляющий от серина воду и присоединяющий сероводород, в результате чего синтезируется аминокислота цистеин. Подобные лиазы также называют синтазами. Следует отличать их от ферментов класса лигаз, которые ускоряют реакции только синтеза и именуются в связи с этим синтетазами. Серин-гидро-лиазу можно также назвать цистеинсинтазой:
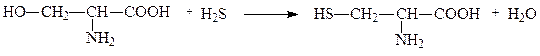
серин цистеин
Изомеразы – немногочисленный класс ферментов, осуществляют внутримолекулярный перенос водорода, фосфатных и ацильных групп, перемещение двойных связей, изменение пространственного расположения атомных группировок.
Триозофосфатизомераза ускоряет перенос атомов водорода в процессе взаимопревращений глицеральдегид-3-фосфата и дигидроксиацетонфосфата:
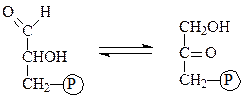
глицеральдегид-3-фосфат дигидроксиацетонфосфат
Фосфоглицератфосфомутаза обеспечивает достаточную скорость превращения 2-фосфоглицерата в 3-фосфоглицерат и обратно:
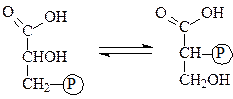
3-фосфоглицерат 2-фосфоглицерат
Мутаротаза является стереоизомеразой, она ускоряет реакцию превращения α-D-глюкопиранозы в β-D-глюкопиранозу. К стереоизомеразам относятся также цис-транс-изомеразы, например ретинол-изомераза, переводящая транс-ретинол в цис-ретинол.
Изопентенилпирофосфат-изомераза катализирует реакцию перестройки изопентенилпирофосфата в диметилаллилпирофосфат, что связано с переме-щением двойной связи из 3-го во 2-е положение:
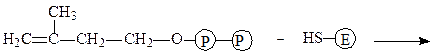
изопентенилпирофосфат фермент
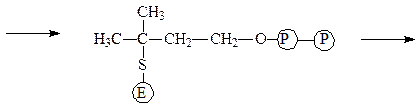
фермент-субстратный комплект
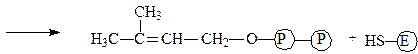
диметилаллилпирофосфат фермент
Изопентенилпирофосфат-изомераза содержит свободные сульфгидрильные группы цистеина, благодаря которым обеспечивается приведенная выше реакция, имеющая огромное значение для синтеза изопреноидов.
Лигазы – ферменты, катализирующие синтез органических веществ в клетке. Главная их особенность – сопряженность синтеза с распадом АТФ. При отрыве от ее молекулы в присутствии лигаз одного или двух концевых остатков фосфорной кислоты выделяется большое количество энергии, используемой для активирования реагирующих веществ. Далее лигазы ускоряют соединение этих активированных субстратов.
К группе лигаз, образующих С-С-связи, относятся карбоксилазы. Например, пируваткарбоксилаза ускоряет реакцию образования оксалоацетата из пирувата и СО2:
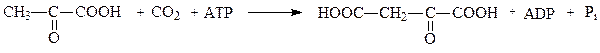
пируват оксалоацетат
В качестве кофермента карбоксилазы используют активированную форму витамина Н (биотина) – карбоксибиотин:
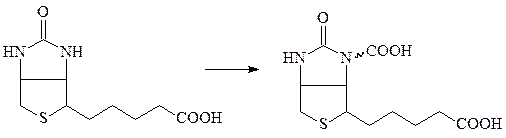
биотин карбоксибиотин
Другим примером работы лигаз может служить ускорение реакции образования C-S-связей, осуществляемое ацил-коэнзим А-синтетазами. Ацетил-коэнзим А-синтетаза катализирует образование ацетил-коэнзима А из уксусной кислоты и коэнзима А:

ацетат коэнзим А ацетил-СоА
Ацетил-коэнзим А служит коферментом в реакциях трансацилирова-ния, поэтому действие ферментов этих двух групп – лигаз и ацилтрансфераз – тесно связано друг с другом.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
1. Комов В.П. Биохимия / В.П.Комов, В.Н.Шведова – М.: Дрофа, 2004.
2. Петров А.А. Органическая химия / А.А.Петров, Х.В.Бальян, А.Т.Трощенко – С.-Пб.: Высшая школа, 2002.
3. Кнорре Д.Г. Биологическая химия / Д.Г.Кнорре, С.Д. Мызина – М.: Высшая школа, 2002.
4. Плакунов В.К. Основы энзимологии / В.К. Плакунов – М.: Логос, 2002.
5. Биохимия. Краткий курс с упражнениями и задачами / под ред. Е.С. Северина, А.Я. Николаева – М.: ГЭОТАР-МЕД, 2001.
6. Кольман Я. Наглядная биохимия: Пер. с нем. / Я.Кольман, К.-Г.Рём – М.: Мир. 2000.
7. Филиппович Ю.Б. Основы биохимии / Ю.Б.Филиппович – М.: Высшая школа. 1999.
8. Геннис Р. Биомембраны: Молекулярная структура и функции: Пер. с англ. / Р. Геннис – М.: Мир, 1997.
9. Мари Р. Биохимия человека. Т.1-2 / Р. Марри, Д. Греннер, П. Мейес, В. Родуэл – М.: Мир, 1993.
10. Ленинджер А. Основы биохимии. Т.1-3 / А. Ленинджер – М.: Мир, 1985.
11. Страйер Л. Биохимия. Т.1-3 / Л. Страйер – М.: Мир, 1984.
12. Уайт А. Основы биохимии. Т.1-3 / А. Уайт, Ф. Хендлер, Э. Смит – М.: Мир, 1981.
13. Степаненко Б.Н. Химия и биохимия углеводов / Б.Н. Степаненко – М.: Высшая школа, 1977.
Дата добавления: 2015-08-08; просмотров: 12409;
