Принцип Паули или запрет Паули (1925 г.): в атоме не может быть двух электронов, обладающих одинаковыми свойствами.
Поскольку свойства электронов характеризуются квантовыми числами, принцип Паули часто формулируется так: в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.
 Максимальное число электронов с одинаковым квантовым числом п выражается формулой: N = 2n2. Отсюда ясно, почему на первом энергетическом уровне может быть не больше 2 электронов, на втором – 8, на третьем – 18 и т. д. Первый энергетический уровень состоит из одного подуровня – 1s, второй, энергетический уровень – из двух подуровней – 2s и 2р, третий – из трех подуровней – 3s, 3р, 3d и т.д.).
Максимальное число электронов с одинаковым квантовым числом п выражается формулой: N = 2n2. Отсюда ясно, почему на первом энергетическом уровне может быть не больше 2 электронов, на втором – 8, на третьем – 18 и т. д. Первый энергетический уровень состоит из одного подуровня – 1s, второй, энергетический уровень – из двух подуровней – 2s и 2р, третий – из трех подуровней – 3s, 3р, 3d и т.д.).
 Состояние электрона в атоме водорода 1Н можно представить как 1s1
Состояние электрона в атоме водорода 1Н можно представить как 1s1
Строение электронной оболочки атома гелия 2Не можно представить как 1s2
 Третий электрон лития согласно принципу Паули уже не может находиться в состоянии 1s, а только в состоянии 2s:
Третий электрон лития согласно принципу Паули уже не может находиться в состоянии 1s, а только в состоянии 2s:
Строение электронных оболочек ряда атомов элементов второго периода периодической таблицы Менделеева:
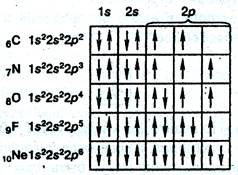
Приведенное расположение спинов определяется так называемым правилом Гунда (1927 г.).
Дата добавления: 2015-08-08; просмотров: 1129;
