Механизмы химических реакций
Все реакции можно подразделить на простые и сложные. Простые протекают в одну стадию и называются одностадийными. Сложные реакции либо идут последовательно (многостадийные реакции), либо параллельно, либо последовательно–параллельно.
Реакции идут по стадиям. Невозможно представить себе, что в реакции образования аммиака N2 + 3H2 = 2NH3 одновременно столкнутся в одной точке пространства четыре молекулы, да еще нужного сорта.
Количество частиц, принимающих участие в элементарном акте химического превращения, называется молекулярностью реакции. Реакции могут быть моно-, би- и тримолекулярными (не больше).
Мономолекулярные – реакции разложения и внутримолекулярные перегруппировки: (J2) = 2(J) .
Бимолекулярные: 2NO2 = N2O4 .
Тримолекулярные (редкие): 2NO + O2 = 2NO2.
В этих примерах порядок и молекулярность совпадают, но в общем случае они различны.
13.7.1 Последовательные реакции
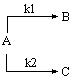
Последовательными называют реакции с промежуточными стадиями, когда продукт предыдущей стадии служит исходным веществом для последующей:
k1 k2
А à B à C.
При k1>>k2 все исходное вещество может превратиться в промежуточный продукт В, прежде чем начнется вторая реакция. Скорость всей реакции определяется второй стадией. При k1<<k2 концентрация промежуточного продукта мала, поскольку он не успевает накапливаться; эта стадия определяет скорость реакции в целом. Таким образом, скорость определяется самой медленной стадией (принцип лимитирующей стадии).
13.7.2 Параллельные реакции
Реакции, в которых исходные вещества способны образовывать разные продукты реакции, называются параллельными.
 |
Например, разложение гидразина:
N2H4àN2+2H2;
3N2H4à4NH3+N2.
В этом случае суммарная скорость реакции разложения гидразина равна сумме скоростей по тому и другому пути.
1.7.3 Сопряженные реакции
Сопряженные реакции – это реакции, в которых с одним и тем же веществом взаимодействуют два и более веществ.
A+BàAB
A+D=AD
13.7.4 Колебательные реакции
В последние годы уделяется большое внимание периодическим процессам, характеризующимся колебаниями концентраций некоторых промежуточных соединений и соответственно скоростями превращения – такие реакции называют колебательными. Наблюдаются такие процессы в газовой и жидкой фазах и особенно часто на границе раздела этих фаз с твердой фазой. Колебательными чаще всего бывают окислительно-восстановительные реакции, а также реакции, сопровождающиеся появлением новой фазы вещества. Причиной возникновения колебаний концентрации является наличие обратных связей между отдельными стадиями сложной реакции.
Пример: реакция, открытая Б.П.Белоусовым – взаимодействие лимонной кислоты с броматом, ускоряемое ионами церия. Раствор регулярно изменяет окраску от бесцветного катализатора (Ce III) к желтому (Ce IV) и обратно. Эти процессы объясняются на основе термодинамики необратимых процессов, крупный вклад в развитие теории колебательных реакций внес И.Р.Пригожин.
Дата добавления: 2015-08-08; просмотров: 793;
