Комплексообразование в растворах.
Комплексные соединения можно получать различными методами. Лиганды и центральные ионы могут взаимодействовать в газовой, жидкой или твердой фазах, но чаще всего комплексные соединения синтезируют в растворах. Со времен Л.А. Чугаева, синтез координационных соединений металлов традиционной проводят по классической схеме идущей от Вернера: ион металла + лиганды → комплекс, при которой исходные органические соединения входят во внутреннюю сферу без изменения своего состава и строения.
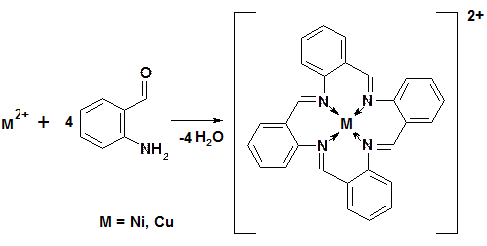
В отличие от традиционной схемы, при «темплатном» синтезе комплексное соединение образуется в результате «реакций на матрицах». Под матрицей понимают координационное соединение металла, в котором донорные атомы лигандов, участвующие в реакции, имеют пространственное расположение благоприятное для протекания реакции конденсации:

В зависимости от типа лиганда, координационного числа и заряда металла комплексообразователя, координационные соединения могут быть неэлектролитами: [Fe(CO)5], [(C5H5)2Fe] и электролитами – соли – K3[Fe(CN)6], кислоты – H2[PtCl6] и основания – [Cu(NH3)4](OH)2.
Как уже указывалось, внутренняя и внешняя сферы координационных соединений сильно отличаются по устойчивости. Частицы, находящиеся во внешней сфере связаны с комплексными ионами преимущественно электростатическими силами и легко отщепляются при растворении комплексов в воде:
[Cu(NH3)4](OH)2 = [Cu(NH3)4]2+ + 2OH-
K3[Fe(CN)6] = 3K+ + [Fe(CN)6]3-
H2[PtCl6] = 2H+ + [PtCl6]2-
Химические свойства комплексного иона с известной электронной конфигурацией и геометрическим строением определяются двумя факторами: а) способностью равновесной системы при определенных условиях к превращениям; б) скоростью, с которой могут происходить превращения, ведущие к достижению равновесного состояния системы.
Термодинамическая стабильность комплекса характеризуется терминами "устойчивый", "неустойчивый", кинетическая - терминами "лабильный" и "инертный". Если при комнатной температуре реакция комплекса протекает за время смешения реагентов (около 1 мин), комплекс относят к лабильным, если реакция протекает с измеримой скоростью и половина времени жизни комплекса более двух мин, такие комплексы называют инертными. Например, константа скорости изотопного обмена молекул воды во внутренней координационной сфере для инертного комплекса [Ni(H2O)6]2+ равна 3,3.104 с-1, а для лабильного [Сr(Н2О)6]3+–5.10-7 с-1.
Главной термодинамической характеристикой процесса комплексообразования является константа равновесия. Например, при взаимодействии в водном растворе солей железа(III) с роданид ионами на первой стадии процесса образуется окрашенное комплексное соединение - монородонид железа(III):
[Fe(H2O)6]3+ + NCS- 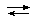 [Fe(H2O)5(NCS)]2+ + H2O
[Fe(H2O)5(NCS)]2+ + H2O
константа равновесия реакции имеет вид
[Fe(H2O)5(NCS)2+][H2O]
 Кравн = [Fe(H2O)63+][NCS-]
Кравн = [Fe(H2O)63+][NCS-]
Так как концентрация воды не изменяется в результате комплексообразования, ее обычно вводят в величину константы равновесия и получают величину, называемую константой устойчивости:
[Fe(NCS)2+]
 Куст = [Fe3+][NCS-]
Куст = [Fe3+][NCS-]
Итак, константа устойчивости представляет собой термодинамическую характеристику, совпадающую по величине с константой образования комплексного соединения без учета процессов гидратации. Иногда для характеристики процессов комплексообразования в растворах используют величины обратные Куст, так называемые константы нестойкости:
Кнест = 1/ Куст
Константы нестойкости представляют собой константы диссоциации комплексных соединений (тоже без учета гидратации). Диссоциация комплексов носит обратимый и ступенчатый характер:
[Ag(NH3)2]+  [Ag(NH3)]+ + NH3
[Ag(NH3)]+ + NH3
[Ag(NH3)]+  Ag+ + NH3
Ag+ + NH3
Ступенчатые константы нестойкости обозначаются К1нест , К2нест:
[Ag(NH3)+][NH3] [Ag+][NH3]

 К1нест = [Ag(NH3)2+] К2нест = [Ag(NH3)+]
К1нест = [Ag(NH3)2+] К2нест = [Ag(NH3)+]
Часто рассчитывают и общие константы устойчивости (нестойкости), которые равны произведению соответствующих последовательных констант и обозначаются b:
Например, К1нест = 1,53·10-3, К2нест = 6,75·10-3, общая константа нестойкости, согласно равновесию
[Ag(NH3)2]+  [Ag]+ + 2NH3
[Ag]+ + 2NH3
имеет вид:
[Ag+][NH3]2
 b = [Ag (NH3)2+] = 1,073.10-7 (b = К1К2)
b = [Ag (NH3)2+] = 1,073.10-7 (b = К1К2)
Чем больше константа устойчивости, тем более прочным является данный комплекс, поскольку ΔG0 = –RT lnβ.
Дата добавления: 2015-07-30; просмотров: 4489;
