Состояние белка, при котором суммарный заряд его равен нулю, называется изоэлектрическим состоянием.
Концентрация водородных ионов (рН), при которой белок находится в изоэлектрическом состоянии называется изоэлектрической точкой белка и обозначается рI.При значении концентрация водородных ионов, равном изоэлектрической точке, аминокислоты не перемещаются в электрическом поле.
Если концентрация водородных ионов ниже изоэлектрической точки, катион аминокислоты движется к катоду, а при pH выше ИЭТ анион аминокислоты — к аноду. В изоэлектрической точке ионы белка не переносятся ни к аноду, ни к катоду. В этой точке достигают своего минимального значения такие свойства белков как: набухание, вязкость, электропроводность. Резко падает растворимость белка и увеличивается его способность к свертыванию.
На этих свойствах аминокислот основана возможность разделения их в электрическом поле (электрофорез).
Кислые аминокислоты имеют ИЭТ в слабокислой среде, основные — в слабоосновной, а нейтральные — в нейтральной.
В изоэлектрической точке отсутствие заряда у молекул белка ослабляет силы отталкивания между белковыми частицами, что благоприятствует агрегации белковых молекул и выпадению белка в осадок, т.е. в изоэлектрической точке раствор белка неустойчив, так как белок теряет один из факторов стабилизации белковых водных растворов – заряд.
При добавлении щелочи или кислоты к белку, выпавшему в осадок в изоэлектрическом состоянии, наступает перезарядка его молекул, и белок вновь переходит в раствор – растворяется.
Так например изоэлектрическая точка (рI) белков … лежит при следующих рН:
Желатин -4,2; Казеин – 4,6; Альбумин яйца – 4,8; Альбумин сыворотки крови -4,8; Гемоглобин – 6,8; Гистон зобной железы 8,7.
В зависимости от соотношения в белке основных (NH-аминных) и кислых (–СООН карбоксильных) группировок и рН среды молекула белка в водном растворе приобретает положительный или отрицательный заряд.
Большинство белков животного происхождения содержатв своем составе больше дикарбоновыхаминокислот аспарагиновой и глютаминовой и поэтому в водных растворах они заряжаются отрицательно (белки-анионы).
Некоторые белки содержат в своем составе значительные количества диаминокислот (аргинина, лизина, гистидина) и поэтому заряжаются положительно (белки-катионы).
Одноименный заряд молекул способствует взаимному отталкиванию частиц, что обеспечивает устойчивость их в водном растворе.
Образование пептида из двух аминокислот идет с выделением молекулы воды.
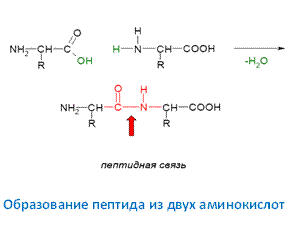
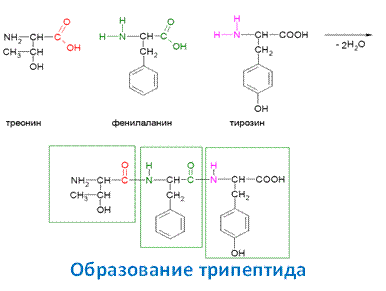
Соответственно, при образовании трипептида будет выделяться уже две молекулы воды.
При образовании белка из n – молекул аминокислот, выделится (n – 1)молекул воды. Поэтому процесс образования пептидов и белков называется не полимеризацией, а поликонденсацией.
Остаток аминокислоты со свободной α – аминогруппой называется N-концевым, остаток аминокислоты с α -карбоксильной группой называется С - концевым, т.е. остаток треонина в данном трипептиде будет являться N – концом, а остаток тирозина С – концом.
Последовательность соединения остатков аминокислот может быть выражена следующим образом:
Н2N-Тhr-Phe-Tyr-COOH
Название пептидов строятся, перечисляя все аминокислоты кроме С - концевой в виде радикалов, оставляя название С – конца неизменным. Трипептид Nhr-Phe-Tyr будет называться следующим образом:
треонил –фенилаланил -тирозин
Отличие пептидов от белков состоит в том, что пептиды обладают низкой молекулярной массой, а белки – высокой. Граница между ними очень размыта и лежит в районе 10000 Д (иногда приводятся значения от 5000, 6000). Важным отличием пептидов от белков является их способность проникать через полупроницаемую мембрану, то есть диализуемость.
МОЛЕКУЛА ИНСУЛИНА, построенная из 51 аминокислотного остатка, фрагменты одинаковых аминокислот отмечены соответствующей окраской фона. Содержащиеся в цепи остатки аминокислоты цистеина (сокращенное обозначение ЦИС) образуют дисульфидные мостики –S-S-, которые связывают две полимерных молекулы, либо образуют перемычки внутри одной цепи.
 Молекулы аминокислоты цистеина HS – CH2 – CH – COOH
Молекулы аминокислоты цистеина HS – CH2 – CH – COOH
NH2
содержат реакционно-способные сульфгидридные группы –SH, которые взаимодействуют между собой, образуя дисульфидные мостики –S-S-.
Роль цистеина в мире белков особая, с его участием образуются поперечные сшивки между полимерными белковыми молекулами.
Объединение аминокислотв полимерную цепь происходит в живом организме под управлением нуклеиновых кислот, именно они обеспечивают строгий порядок сборки и регулируют фиксированную длину полимерной молекулы

Шесть молекул инсулина ассоциированы в гексамер (видны три симметричные оси). Молекулы удерживают вместе остатки гистидина, связанные ионами цинка. Введенный инсулин находится под кожей в виде гексамера, постепенно распадаясь на биологически активные мономеры, поступающие в кровоток.

Рисунок – Ассоциация 6 молекул инсулина
Дата добавления: 2015-06-05; просмотров: 3584;
