Опыты Резерфорда и ядерная модель атома
В развитии представлений о строении атома большое значение сыграли опыты Резерфорда 1909–1911 годах по рассеиванию a-частиц, которые вылетают из атомов радиоактивных элементов. α-частицы –это полностью ионизированные атомы гелия (ядра атомов гелия). Масса α-частиц приблизительно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду 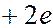 . Опыт осуществлялся следующим образом. Из свинцового контейнера
. Опыт осуществлялся следующим образом. Из свинцового контейнера 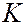 с радиоактивным веществом пучок
с радиоактивным веществом пучок  частиц направлялся на тонкую золотую фольгу
частиц направлялся на тонкую золотую фольгу 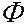 толщиной 10-7 м. При прохождении через фольгу
толщиной 10-7 м. При прохождении через фольгу 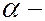 частицы отклонялись от первоначального направления на различные углы
частицы отклонялись от первоначального направления на различные углы 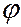 . Фольга берется достаточно тонкой, чтобы избежать многократного рессеяния, т.е. чтобы наблюдаемое отклонение
. Фольга берется достаточно тонкой, чтобы избежать многократного рессеяния, т.е. чтобы наблюдаемое отклонение 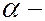 частиц было результатом одного рассеяния. Рассеянные
частиц было результатом одного рассеяния. Рассеянные 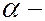 частицы ударялись об экран
частицы ударялись об экран  , покрытый сернистым цинком. Вызываемые ими сцинтилляции наблюдались в микроскоп
, покрытый сернистым цинком. Вызываемые ими сцинтилляции наблюдались в микроскоп 
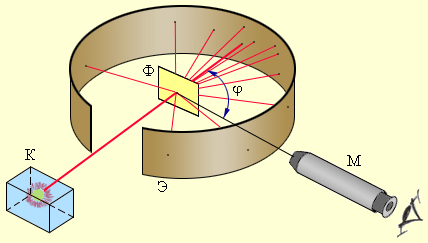
Схема опыта Резерфорда по рассеянию  -частиц
-частиц
Оказалось, что большинство 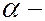 частиц рассеивалось на небольшие углы порядка 1 – 3 º. Однако наблюдались отдельные
частиц рассеивалось на небольшие углы порядка 1 – 3 º. Однако наблюдались отдельные 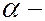 частицы, отклоняющиеся на большие углы, доходившие до 150º. Относительное число таких частиц было невелико. Из этого Резерфорд сделал вывод, что модель атома Томсона неверна. Если бы положительный заряд был распределен по объему атома равномерно, как предлагал Томсон, то a-частицы при соударении с атомом не могли бы сильно изменять направление своего движения. Проанализировав результаты экспериментов, Резерфорд предположил, что столь сильное отклонение
частицы, отклоняющиеся на большие углы, доходившие до 150º. Относительное число таких частиц было невелико. Из этого Резерфорд сделал вывод, что модель атома Томсона неверна. Если бы положительный заряд был распределен по объему атома равномерно, как предлагал Томсон, то a-частицы при соударении с атомом не могли бы сильно изменять направление своего движения. Проанализировав результаты экспериментов, Резерфорд предположил, что столь сильное отклонение 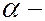 частиц возможно только в том случае, если внутри атома имеется чрезвычайно сильное электрическое поле, создаваемое положительным зарядом, связанным с большой массой и сосредоточенным в очень малом объеме. На основе разработанной количественной теории рассеяния
частиц возможно только в том случае, если внутри атома имеется чрезвычайно сильное электрическое поле, создаваемое положительным зарядом, связанным с большой массой и сосредоточенным в очень малом объеме. На основе разработанной количественной теории рассеяния 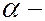 частиц, Резерфорд оценил размеры области в которой сосредоточен положительный заряд – примерно 10-14 - 10-15 м.
частиц, Резерфорд оценил размеры области в которой сосредоточен положительный заряд – примерно 10-14 - 10-15 м.
Основываясь на полученных результатах, Резерфорд предложил в 1911 г. ядерную (планетарную) модель атома. Согласно этой модели атом представляет собой систему зарядов, в центре которой находится тяжелое положительно заряженное ядро с зарядом 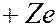 , имеющее размеры, не превышающие 10-14 м, а вокруг него расположены
, имеющее размеры, не превышающие 10-14 м, а вокруг него расположены 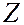 электронов, распределенных по всему объему атома. Суммарный заряд электронов равен заряду ядра. Почти вся масса атома сосредоточена в ядре.
электронов, распределенных по всему объему атома. Суммарный заряд электронов равен заряду ядра. Почти вся масса атома сосредоточена в ядре.
 Однако ядерная модель оказалась в противоречии с законами классической механики и электродинамики. Так как система неподвижных электрических зарядов не может находиться в устойчивом состоянии, Резерфорд предположил, что электроны обращаются вокруг ядра по замкнутым (круговым) траекториям. Из-за наличия центростремительного ускорения электрон, согласно классической электродинамике, должен непрерывно излучать электромагнитные волны. В результате потери энергии радиус орбиты электрона должен непрерывно уменьшаться и, в конце концов, электрон должен упасть на ядро, т.е. с точки зрения классической физики атом в виде планетарной модели вообще существовать не может. Кроме того, излучение электрона в планетарной модели атома не может быть монохроматичным. С точки зрения классической физики частота излучения атома должна совпадать с частотой обращения электронов вокруг ядра. Но по мере приближения электрона к ядру вследствие закона сохранения момента импульса (
Однако ядерная модель оказалась в противоречии с законами классической механики и электродинамики. Так как система неподвижных электрических зарядов не может находиться в устойчивом состоянии, Резерфорд предположил, что электроны обращаются вокруг ядра по замкнутым (круговым) траекториям. Из-за наличия центростремительного ускорения электрон, согласно классической электродинамике, должен непрерывно излучать электромагнитные волны. В результате потери энергии радиус орбиты электрона должен непрерывно уменьшаться и, в конце концов, электрон должен упасть на ядро, т.е. с точки зрения классической физики атом в виде планетарной модели вообще существовать не может. Кроме того, излучение электрона в планетарной модели атома не может быть монохроматичным. С точки зрения классической физики частота излучения атома должна совпадать с частотой обращения электронов вокруг ядра. Но по мере приближения электрона к ядру вследствие закона сохранения момента импульса ( 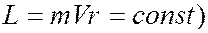 должна возрастать скорость обращения его вокруг ядра, а следовательно и частота испускаемых спектральных линий. Таким образом, исходя из ядерной модели атома и представлений классической физики оказалось невозможным объяснить установленные экспериментально закономерности излучения атомов.
должна возрастать скорость обращения его вокруг ядра, а следовательно и частота испускаемых спектральных линий. Таким образом, исходя из ядерной модели атома и представлений классической физики оказалось невозможным объяснить установленные экспериментально закономерности излучения атомов.
Дата добавления: 2015-05-26; просмотров: 1139;
