Влияние температуры на химическое равновесие. Уравнение изобары реакции.
Для определения зависимости 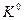 от температуры в дифференциальной форме воспользуемся уравнением Гиббса – Гельмгольца (III,35)
от температуры в дифференциальной форме воспользуемся уравнением Гиббса – Гельмгольца (III,35)
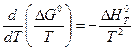
и уравнением (V,10)
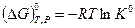
Комбинируя приведенные выше уравнения, получим
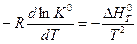 или
или 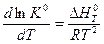 (V,11)
(V,11)
Уравнение (V,11) называется уравнением Вант-Гоффа или уравнением изобары реакции(процесс осуществляется при P = const).
Для небольшого интервала температур 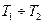 тепловой эффект реакции можно принять постоянным. После интегрирования с учетом сделанного допущения уравнение (V,11) примет вид
тепловой эффект реакции можно принять постоянным. После интегрирования с учетом сделанного допущения уравнение (V,11) примет вид
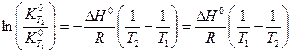 (V,12)
(V,12)
Выражение (V,12) позволяет вычислить константу равновесия при одной из температур, если известны ее значение при другой температуре, а также тепловой эффект реакции.
При неопределенном интегрировании уравнения (V,11) получим
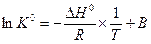 (V,13)
(V,13)
где В – константа интегрирования.
Согласно уравнению (V,13) зависимость 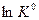 от обратной температуры
от обратной температуры 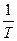 выражается прямой, тангенс угла наклона которой равен
выражается прямой, тангенс угла наклона которой равен 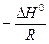 , а отрезок, отсекаемый прямой на оси ординат, равен В.
, а отрезок, отсекаемый прямой на оси ординат, равен В.
Этот метод вычисления теплового эффекта обычно используется, если его непосредственное определение (или вычисление по закону Гесса) затруднено, например, в тех случаях, когда реакция осуществляется только при высоких температурах.
Согласно уравнению (V,13) влияние температуры на константу равновесия определяется знаком теплового эффекта.
Если 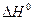 > 0 (эндотермический процесс), то в координатах
> 0 (эндотермический процесс), то в координатах 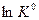 -
- 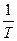 тангенс угла наклона прямой будет иметь отрицательное значение (угол наклона - тупой), следовательно, с повышением температуры константа будет увеличиваться, т.е. химическое равновесие смещается в сторону продуктов реакции (смотри рис. 9«а»).
тангенс угла наклона прямой будет иметь отрицательное значение (угол наклона - тупой), следовательно, с повышением температуры константа будет увеличиваться, т.е. химическое равновесие смещается в сторону продуктов реакции (смотри рис. 9«а»).
При 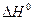 < 0 (экзотермическая реакция) тангенс угла наклона прямой будет иметь положительное значение (угол наклона - острый). С повышением температуры константа равновесия будет уменьшаться и химическое «равновесие смещается в сторону исходных веществ (смотри рис.9«б»).
< 0 (экзотермическая реакция) тангенс угла наклона прямой будет иметь положительное значение (угол наклона - острый). С повышением температуры константа равновесия будет уменьшаться и химическое «равновесие смещается в сторону исходных веществ (смотри рис.9«б»).
Рис.9. Зависимость логарифма константы химической реакции от обратной
температуры (рис. «а»: 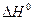 > 0 - эндотермический процесс; рис. «б»:
> 0 - эндотермический процесс; рис. «б»: 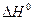 < 0 - экзотермический процесс)
< 0 - экзотермический процесс)
Дата добавления: 2015-05-21; просмотров: 1781;
