Термическая диссоциация в газах. Степень диссоциации
Среди реакций, возникающих при столкновении молекул различных веществ, особо следует выделить реакции термической диссоциации.
Разложение более сложных веществ на более простые под влиянием высокой температуры называется термической диссоциацией. Обратное направление процесса сопровождается рекомбинацией молекул. Например, для водяного пара имеем
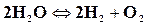 ,
, 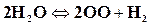 ;
;
для углекислоты 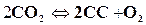 .
.
При высоких температурах (2500◦С и более) двухатомные газы разлагаются на одноатомные
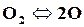 ,
, 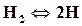 ,
, 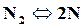 .
.
Диссоциация – реакция противоположного направления реакции горения и поэтому она требует затраты энергии извне и идет с поглощением теплоты, т. е. это реакция эндотермическая. Энергия эта расходуется на разрыв связей и на сообщение кинетической энергии вновь освобождающимся частицам. Диссоциация конечных продуктов сгорания указывает на неполноту реакции, на не полноту выделения теплоты и, следовательно, приводит к снижению К.П.Д. камеры сгорания.
Степенью диссоциацииα называется доля моля конечного вещества реакции, разложившегося к моменту равновесия на исходные. Например, горение водорода выражается формулой
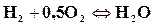
Из формулы видно, что при полном сгорании одного моля водорода в половине моля кислорода получается один моль водяного пара. Вследствие диссоциации не проходит полного окисления. При степени диссоциации, равной α, к моменту равновесия в смеси будет не 1 моль водяного пара, а только (1─α) моль, В смеси останутся продукты диссоциации, а именно водород и кислород. Число молей водорода будет вдвое больше, чем кислорода, так как при разложении одной молекулы водяного пара получается одна молекула водорода и половина молекулы кислорода. Следовательно, в смеси будет α мольводорода и 0,5 α моль кислорода. По этим данным можно определить состав диссоциированных продуктов сгорания.
По степени диссоциации можно определить состав смеси реагирующих веществ в момент равновесия, а так как константа равновесия также позволяет определить этот состав, то обе эти величины должны быть связаны между собой, т. е. 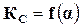 или
или 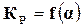 .
.
Дата добавления: 2015-04-03; просмотров: 4521;
