Теоретическая часть. Скорость химической реакции измеряется изменением концентрации реагирующих веществ в единицу времени и может быть определена по формуле:
Скорость химической реакции измеряется изменением концентрации реагирующих веществ в единицу времени и может быть определена по формуле:
V= ± 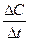
где V - скорость, моль/(л∙с)
∆ C - изменение концентрации, (моль/л)
t -время (с)
Она зависит от природы реагирующих веществ и условий реакции: концентрации, температуры и присутствия катализатора. Зависимость скорости реакции от концентрации реагирующих веществ определяется законом действия масс: скорость химической реакции при данной температуре прямо пропорциональна произведению концентрации реагирующих веществ. Математически этот закон для уравнения реакции:
m A + n B = g C
можно представить в следующем виде:
V = K [A]m . [B]n ,
где V – скорость реакции
[А] и [В] - молярные концентрации реагирующих веществ
m, n ,g - коэффициенты в уравнении реакции
К - константа скорости, численно равная скорости реакции, когда произведение концентрации реагирующих веществ равно единице.
Зависимость скорости реакции от температуры определена опытным путем. При повышении температуры на каждые 10о скорость большинства реакций увеличится в 2-4 раза (правило Вант-Гоффа). Это правило математически выражается так:
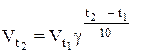
где 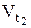 – скорость реакции после повышения температуры до t2
– скорость реакции после повышения температуры до t2
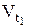 - начальная скорость реакции при температуре t1
- начальная скорость реакции при температуре t1
γ- температурный коэффициент, т.е. число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры на 10о С.
Дата добавления: 2015-01-21; просмотров: 904;
