Несгоревшие углеводороды
В процессе сгорания углеводородных топлив СmНn при условии, что αв > 1, за фронтом пламени несгоревшие углеводороды СН (их обозначают также как НС) не присутствуют. Они образуются в зонах, которые не были охвачены (или охвачены частично) горением. В связи с этим в состав несгоревших углеводородов может входить множество различных компонентов, которые или полностью не сгорели, или сгорели частично. В настоящее время законодательные акты ограничивают только суммарное количество компонентов СН, никак не указывая при этом на их состав, т. е. не учитывают потенциальную опасность отдельных компонентов для здоровья человека и окружающей среды. В бензиновых двигателях большая часть несгоревших углеводов выбрасывается в атмосферу сначала при холодном пуске, а затем и в эксплуатационном режиме работы. Они образуются вследствие гашения пламени при его приближении к холодной поверхности стенки КС, в зазорах и щелях за счет сильного охлаждения его фронта, а также при малой скорости перемещения фронта «ни в процессе расширения (при резком падении температуры).
Известно, что пламя гаснет, когда отношение теплоты, выделенной в пламени, к теплоте, отводимой от пламени к поверхности стенки, достигает определенного значения, что приближенно можно описать числом Пекле
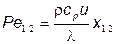 (7.51)
(7.51)
в которое кроме термодинамических параметров газа входит скорость фронта пламени и. Индексы 1 и 2 соответственно указывают на оба случая (стенка и щель) гашения пламени, а величины х1 и х2 влияют собой характерные размеры — расстояние до поверхности стенки КС и линейный размер зазора соответственно. Многочисленные экспериментальные наблюдения позволили установить, что критическими значениями числа Пекле, приводят ми к гашению пламени, являются
Ре1 = 8 и Ре2 = 40. При этом х1/х2= 0,2, а характерные размеры х1, х2 находятся в диапазон значений 0,02 < х1 < 0,2 мм и 0,1 < х2 < 1,0 мм [27].
В то же время, исходя из приблизительной оценки чисел Нусельта и Рейнольдса, можно принять, что толщина термического пограничного слоя у поверхности стенки КС δТ ≈1 мм. Следовательно, гашение пламени происходит при температуре, близкой температуре стенки, а не к температуре газа.
В начале процесса сгорания около 6 % смеси попадает в зазор между поршнем и гильзой и только 2 % к концу процесса сгорания возвращается обратно в цилиндр двигателя. К этому моменту времени температура в цилиндре чаще всего успевает снизиться до такого уровня, что дальнейшее полное догорание смеси становится невозможным. При движении поршня вверх несгоревшие углеводороды вместе с продуктами сгорания вытесняются из КС. Влияние формы камеры сгорания на концентрацию несгоревших углеводородов в отработавших газах подробно проанализировано в[19].
В настоящее время существуют различные варианты механизмов образования СН в бензиновых двигателях [27], однако сложны и не отличаются высокой достоверностью, в связи с чем получить надежные расчетные данные концентрации СН проблематично. Для оценки скорости реакции оксидации несгоревших углеводородов, образующихся в цилиндре двигателя, можно пользоваться следующим соотношением:
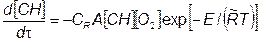 (7.52)
(7.52)
где Е = 156 Дж/моль; А = 6,7-1021 м7(моль-с). Безразмерный коэффициент СR, обеспечивающий удовлетворительное соглашение с опытными данными, меняется в довольно широких пределах: С* = 0,1...1,0.
Несгоревшие углеводороды обычно разбивают на четыре группы: ароматические (45 %), алканы (20 %), алкены (30 °) альдегиды (5 %). В ароматические углеводороды входят так называемые полицикличные углеводороды, играющие значительную роль в образовании сажи в дизелях.
Образование несгоревших углеводородов СН в КС дизелей носит более сложный характер, чем в КС бензиновых двигателей и поэтому в настоящее время нет надежных методов расчета их концентрации. Основными источниками происхождения СН в дизелях являются:
внешняя грань (поверхность) топливного факела, в области которой локальный состав смеси настолько обеднен, что находится за пределами воспламенения;
внутренняя область топливного факела с переобогащенной топливом смесью;
диффузионное пламя, гашение которого связано с резким снижением температуры и давления в процессе расширения;
попавшее на поверхность стенки КС топливо, не сгоревшее полностью вследствие невысокой температуры;
образовавшиеся при дополнительном впрыскивании или под впрыскивании, сопровождающихся повторным открытием соплового отверстия, капли топлива крайне больших размеров, испарение и сгорание которых затягивается;
несгоревшее к концу процесса сгорания топливо, осевшее в так называемых мертвых (вредных) объемах распылителя (см. далее гл. 10). При этом установлено, что концентрация несгоревших углеводородов в отработавших газах зависит от мертвых объеме почти прямолинейно [27].
Очевидно, что указанные источники влияют на образование СНи в бензиновых двигателях с непосредственным впрыскиванием топлива.
В общую массу несгоревших углеводородов кроме указанных выше входит также ряд субстанций, содержание которых на сегодняшний день еще не ограничивается, но они представляют опасность для здоровья человека и окружающей среды. К ним относятся карбонильные соединения, а также диоксины и фураны [26].
Карбонильные соединения могут воздействовать на человеческий организм как непосредственно, так и через другие вещества, имеющиеся в атмосфере. Например, они совместно с диоксидами азота способствуют образованию озона в околоземном пространстве, т. е. так называемого фотохимического смога. К карбонильным соединениям причисляют альдегиды и кетоны, которые имеют, как минимум, одну характерную карбонильную группу. Они возникают в виде частично сгоревших компонентов топлива, полная оксидация которых преждевременно была прервана.
Диоксины представляют собой ароматические углеводороды химическими соединениями различного характера — от полностью нетоксичных до крайне токсичных. Под диоксинами часто понимают также близкий к ним как с химической, так и с токсической зрения класс фуранов. В 1976 г. в Севесо (Италия) произошла крупная промышленная авария, сопровождающаяся выделением токсичного 2,3,7,8-тетрахлордибензо-n-диоксина, названного впоследствии Севесо-яд. В настоящее время все диоксины часто объединяют этим термином. Их химическое строение проанализировано в [27].
В заключение отметим, что концентрация всех диоксинов и фуранов достигает порядка 10-9 кг на 1 кг отработавших газов, концентрация собственно Севесо-яда еще меньше и составляет 10-14 кг на 1 кг отработавших газов. Такие низкие концентра обычно находятся за пределами обнаружения современными методами измерения.
\
7.8.4. Твердые частицы
Под твердыми частицами в отработавших газах понимают вещества, которые улавливаются специальным фильтром после того, как отработавшие газы определенным способом разбавляются и охлаждаются до температуры ниже 52 °С. В дизелях различают твердые частицы двух видов: органические (~ 95 %) и неорганические (~ 5 %). К органическим относятся углерод (чистая сажа) и полициклические ароматические углеводороды, а к неорганическим — зола от присадок моторного масла, частицы солей и ржавчины, металлические частицы, а также керамическое волокно (рис. 7.9). Сложные химико-физические процессы образования твердых частиц или сажи в настоящее время недостаточно изучены, этому не существует надежных методов для расчета их концентраций. Современное понятие процесса образования сажи основано на следующей поэтапной схеме:
химическое преобразование молекул топлива в молекулы ацетилена (С2 Н2) и в С3Н3-ионы, образование первого бензольного кольца;
образование полициклических ароматических углеводород путем полимеризации и дегидрирования, при этом происходит рост относительного числа атомов углерода (С);
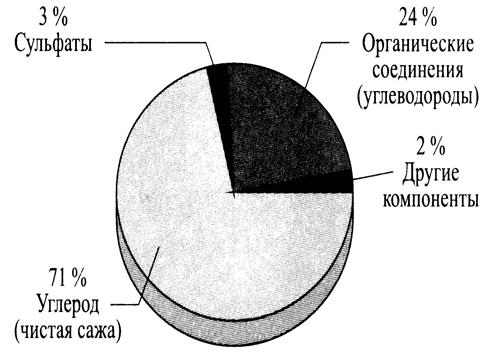
Рис. 7.9. Состав твердых частиц в отработавших газах дизеля
конденсация и образование сажистых ядер (нуклеация) с размерами порядка 1… .2 нм;
объединение сажистих ядер в первичные частицы сажи (процесс роста поверхности частиц), диаметры которых достигают 20...30 нм, с последующим наслоением на них других субстанций;
объединение первичных частиц сажи в удлиненные структуры цепочной формы (процесс агломерации);
разрушение частиц сажи вследствие взаимодействия (оксидации) с молекулой кислорода (О2) и свободным радикалом (ОН).
Размеры частиц сажи, образованных в КС дизелей, изменяются в довольно широких пределах — от 0,01 мкм до 10,0 мкм, при этом максимум распределения по размерам приходится приблизительно на 0,1 мкм (100 нм). Плотность частиц сажи составляет 1 700...2 000 кг/м3, а отношение площади поверхности частицы к ее массе лежит в пределах 20...200 м2/г [27].
Роль температуры в процессе образования сажи пока еще остается предметом дискуссий, поскольку высокая температура способствует как возникновению сажи (пиролиз), так и ее уничтожению (оксидация). Критическим считается интервал температуры 1500 <Т<1900 К(рис. 7.10), называемый критическим окном. Как следует из рисунка, выброс сажи особенно ощутим при коэффициенте избытка воздуха 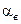 <0,6. На рис. 7.11 приведено изменение концентрации сажи в дизеле в зависимости от времени, наиболее интенсивно сажа образуется в начале процесса сгорания. При развитом процессе сгорания и догорании большая часть выделенной сажи выгорает. Поэтому концентрация сажи, обнаруженная в отработавших газах измерительными приборами, составляет только
<0,6. На рис. 7.11 приведено изменение концентрации сажи в дизеле в зависимости от времени, наиболее интенсивно сажа образуется в начале процесса сгорания. При развитом процессе сгорания и догорании большая часть выделенной сажи выгорает. Поэтому концентрация сажи, обнаруженная в отработавших газах измерительными приборами, составляет только
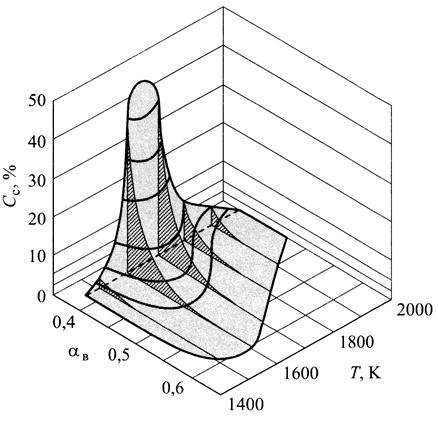
Рис. 7.10. Изменение концентрации сажи в зависимости от коэффициента избытка воздуха и температуры
небольшую долю (~ 0,1... 1,0 %) максимальной концентрации сажи в КС. Это является одной из причин, усложнивших изучение химических и физических процессов, доминирующих в процессе образования сажи. В связи с этим моделирование процессов образования и выгорания (оксидации) сажи в настоящее время только начинает развиваться. Однако достоверно установлено, что решающие значения в этих процессах имеют локальные значения температуры, массы кислорода и массы паров топлива. Эти параметры оказывают влияние прежде всего на скорость реакции образования и выгорания сажи. В связи с этим часто применяют простую модель [28], основанную на двух уравнениях с эмпирическими коэффициентами:
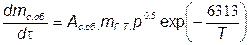 ,
,
где mс.об— масса сажи, образующейся в отработавших газах;
mГ.Т— масса газообразного топлива,
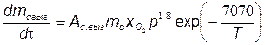
m 
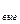 -масса сажи ,выгоревшая в процессе сгорания топлива.
-масса сажи ,выгоревшая в процессе сгорания топлива.
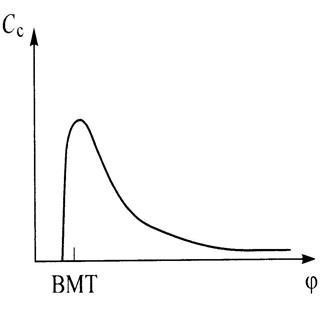
Рис.7.10 Изменение концентрации сажи в зависимости от коэффициента избытка воздуха и температуры
Тогда скорость изменения массы сажи
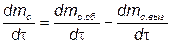 (7.54)
(7.54)
В этих уравнениях Ас.об  и Ас.выг–постоянные величины, характеризующие скорость образования и выгорания сажи и соответсвенно,бар-0,5с-1;mисп.т-масса испарившегося топлива,г;m
и Ас.выг–постоянные величины, характеризующие скорость образования и выгорания сажи и соответсвенно,бар-0,5с-1;mисп.т-масса испарившегося топлива,г;m
7.8.5. Оксиды азота
При сгорании топлива в поршневых двигателях в основном образуется оксид азота (NО), который при долгом пребывании в атмосферных условиях почти полностью превращается в диоксид азота (NO2). В зависимости от происхождения различают три механизма образования оксида азота: топливный, образующийся азота, находящегося в топливе; «быстрый», образующийся фронте пламени из азота, находившегося в воздухе в соответствии с механизмом, описанным в [24]; термический, образующийся высокотемпературных продуктах сгорания из азота, находившийся в воздухе согласно механизму, описанному в [4, 17].
Преобразование азота, содержащегося в топливе, в оксид азота в процессе сгорания в поршневых двигателях практически не играет роли, так как топливо для этих двигателей почти не содержит связанного азота. Этот механизм возникновения NО действует в случае горения так называемого «очищенного» угля, содержащего примерно 1 % азота.
Скорость образования топливного NО определяется скоростью двух реакций:
N + ОН→ NО + Н (7.56)
N + NО →N2 + О(7.57)
для которых, как известно, имеются достаточно надежные данные констант скоростей реакций.
Механизм образования «быстрого» NО принципиально отличается от механизма образования термического NО и носит более сложный характер, так как тесно связан с образованием свободного радикала (СН). Механизм образования «быстрых» NО впервые описал С. Фенимор [24]. Скорость образования оксида азота определяется скоростью реакции между промежуточным свободным радикалом (СН) и молекулой азота (N2). В результате этой реакция получается цианисто-водородная (синильная) кислота (НСN), которая входит в реакцию со свободным радикалом (N) и очень быстро образуется N0. Реакция образования «быстрых» N0 им вид
СН +N2→HCN+N→…→ NО (7.58)
где 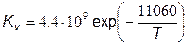 ,
, 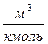 . Возникновению свободного радикала (СН) предшествует образование ацетилена (ацетилен С2Н2) во фронте пламени в условиях обогащенной смеси. Вследствие относительно низких значений энергии активации образование «быстрых» оксидов начинается уже при температуре Т > 1000 К. Оксидация промежуточных продуктов (НСN и СN) происходит но следующим реакциям:
. Возникновению свободного радикала (СН) предшествует образование ацетилена (ацетилен С2Н2) во фронте пламени в условиях обогащенной смеси. Вследствие относительно низких значений энергии активации образование «быстрых» оксидов начинается уже при температуре Т > 1000 К. Оксидация промежуточных продуктов (НСN и СN) происходит но следующим реакциям:
HCN+ON→CO+H (7.59)
CN+O2→CO+O (7.60)
HCN+OH→CN+H2O (7.61)
где константы скорости прямой Кv и обратной Кr реакций равны соответственно:
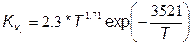 ,
, 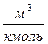
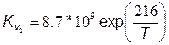 ,
, 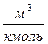
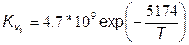 ,
, 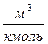
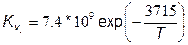 ,
, 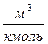
Промежуточные реакции превращения NСО в оксид азота протекают относительно быстро, поэтому скорость образования «быстрого» NО
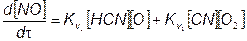 (7.62)
(7.62)
Концентрации [ОН] и [О], как и в случае термических образований оксидов азота, определяются на основе так называемой ОНС-системы реакций, рассмотренных ниже. Следует отметить, что в туре, как это показано в [33], имеются противоречивые данные относительно константы скорости реакции (7.58). Поэтому «быстрого» NО по сравнению с термически NО характеризуется меньшей достоверностью. Образование «быстрого» NО, в отличие термического NО, не так существенно зависит от температуры и происходит при низких температурах. Однако образование «быстрого» NО сильно зависит от локальных значений концентрации топлива (от локального коэффициента избытка воздуха]. Это объясняется тем, что от локального коэффициента избытка воздуха в значительной степени зависит возникновение свободного радикала (СН) и синильной кислоты (НСN).
Веселящий газ (М20),обладающий наркотическим воздействием, является причиной образования оксида азота в том случае, когда обедненная топливовоздушная смесь ограничивает образование свободного радикала СН и тем самым блокирует возникновение «быстрых» NО,и тогда дальнейший незначительный рост температуры мешает образованию термических NО.При этом оксид азота образуется по схеме, аналогичной схеме первой определяющей реакции механизма Зельдовича:
N2+O+M→N2O+M (7.63)
Молекула М какого-либо вещества, не участвующего в реакции, способствует возникновению именно N2О ,а не NО,который образуется уже после оксидации N2О:
N2O+O→NO+NO (7.64)
Поскольку образование N2О происходит в результате соударения трех молекул, то вероятность осуществления этой реакции предпочтительнее для случаев с высокими давлениями. Низкие температуры не способны затормозить эту реакцию. Подчеркнем, что N2О является основным источником возникновения NО вгазовых турбинах при их работе на обедненных смесях. Этот механизм может играть определенную роль и в бензиновых двигателях работающих на значительно обедненных смесях [27].
Образование термического NОпроисходит в зонах сгоревшего топлива (в продуктах сгорания) вслед за фронтом пламени, и его механизм впервые был описан и обоснован Я.Б. Зельдовичем [5]:
O+N2 →NO+N (7.65)
N+O2→ NO+O (7.66)
В дальнейшем механизм Зельдовича был развит Д. Баулхом ,который к этим двум реакциям добавил еще одну
N+OH→NO+H (7.67)
Константы скорости реакции определяют экспериментально. Термический механизм Зельдовича является наиболее подробно изученным из всех известных механизмов образования оксидов тем не менее существует опасность получения неточных результатов, связанная с выбором указанных констант из литературных источников.
Анализ российских и зарубежных расчетных моделей образования N0 в поршневых двигателях показывает, что характерным для их является не только использование различных уравнений химической кинетики, но и чрезмерное упрощение условий в КС. В.А.Звонов для дизелей [6] в отличие от А. Урлауба, Г. Хайдера и .следователей [7, 25, 30, 32] применяет не расширенный, а классический механизм Зельдовича, при этом реакцию (7.67) он предлагает учитывать только для двигателей с электрическим зажиганием. Параллельно с механизмом Зельдовича Звонов рассматривает бимолекулярный механизм (реакция N2 + O2 → NO приводит к выводу, что расчеты образования NO в двигателях провести с помощью либо двух реакций (классический механизм Зельдовича), либо трех (классический механизма Зельдовича +бимолекулярная реакция). Отметим, что одна из причин создания расширенного механизма Зельдовича- недостоверность бимолекулярной модели [17].
В последнее время используют схемы образования оксидов азота с большим количеством промежуточных реакций. К ним относятся: модель Клейншмидта [30], в которой к трем реакциям расширенного механизма Зельдовича добавлены еще 17; модель образования NO при горении метана, предложенная в [3] и содержащая 196 реакций для 32 компонентов. Заслуживают также интерес работы, посвященные решению сопряженных задач тепломассообмена и химической кинетики [15]. Полученные при этом поля температур и диффузий позволяют определить локальные зоны, где компоненты смеси интенсивно реагируют, а смесь получается слабореагирующей. Во всех этих моделях присутствуют три реакции расширенного механизма Зельдовича, наиболее широко распространенного широко распространенного в теории поршневых двигателей.
Расчет концентрации оксидов азота. Согласно кинетическое уравнение образования оксида азота имеет
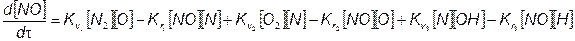
кинетическое уравнение изменения концентрации азота
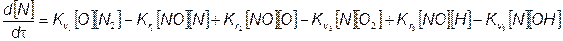
Здесь, как и выше, квадратные скобки обозначают кон соответствующих компонентов реакций. Для решения нений необходимо предварительно определить концентрации О, N,О2, N2, ОН и Н, которые в данном случае приняты известными (метод их определения изложен ниже). Тогда в результате решения обыкновенного дифференциального уравнения (7.68) можно получить изменение концентраций [NO] по времени (по углу поворота коленчатого вала).
Однако для этого прежде всего требуется задание скоростей химических реакций. При этом зависимость этих констант от температуры определяется на основе закона Аррениуса(7.18), который в данном случае применяется в следующем виде:
К =10-3 АТв ехр(-Е/(RТ)),
где К в м3/(кмоль • с); А— см3/(моль*с); Е— энергия энерции, кДж/кмоль; В— безразмерная постоянная R= 8,134 кДж/(кмоль• К) — универсальная газовая табл. 7.1). Коэффициенты А, В,а также энергию активации травило, определяют на основании анализа эмпирических 8, 10, 16, 17, 20-23, 29, 32, 34], которые обычно различаются. В связи с этим при их выборе необходимо исходить из соображений:
константы для всех кинетических реакций при использовании расширенного механизма Зельдовича следует по возможность подбирать из одного источника;
граничные условия (температура и коэффициент избытка воздуха, при которых определены эти константы, максимально должны соответствовать условиям процесса сгорания в поршневых двигателях.
С этой точки зрения работа [29] является наиболее удобной, так как в ней приведены значения констант для прямой и обратной реакций, которые определены с применением статистической обработки многочисленных данных, полученных другими исследователями.
В то же время константы, полученные в [34], часто используют при расчете образований NO в соответствии с механизм Зельдовича, т. е. согласно первым двум реакциям в (7.65) и (7.66) В случае использования расширенного механизма Зельдовича третьей реакции в (7.67) следует добавить данные, предложены в [32]. Четыре различных комбинации констант скорости кинетической реакции, т. е. эмпирических коэффициентов Аи В,а также энергии активации Е,приведены в табл. 7.1. По результатам многих численных расчетов и их сравнения с результатами экспериментальных исследований дизелей КамАЗ, ЯМЗ и ЗМЗ были выбор значения коэффициентов для вычисления констант скоростей реакций (в табл. 7.1 выделены полужирным шрифтом) [7].
При повышении температуры от 2000 до 2500 К концентрации NО термического происхождения может повыситься почти в 50 [27], что, из-за такой сильной зависимости от температуры, позволяет. говорить о кинетически регулируемом механизме образования (рис. 7.12). В начале кинетического регулируемого процесса в соответствии с механизмом Зельдовича разуются оксиды азота с меньшейконцентрацией (разность
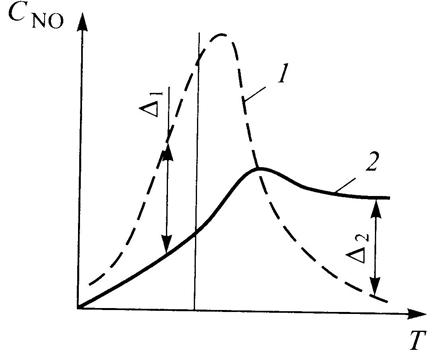
Рис. 7.12. Изменение концентрации NO при равновесном процессе (1) и кинетическом механизме его образования(2)
составляет ∆1 ) , однако в заключительной фазе процесса сгорания, когда температура снижается, медленно при механизме его образования NO не сопровождается заметным обратным процессом его распада В таком случае говорят, что происходит «замораживание» лопаток реакции, или «закалка», образованного NO. Соответственно скорость распада NO в обратных реакциях зависит от температуры несколько слабее, чем в прямых. Таким образом концентрация оксидов азота при резком падении температуры остается на уровне, близком к тому, который имеет при максимальных значениях температуры.
Скорости прямых реакций (7.66) и (7.67) значительно повышению со скоростью реакции (7.65), поэтому атомы а (7.65)) в последующих реакциях (7.66) и (7.67) практически у преобразуется в N0. В связи с этим концентрация атома юта за короткий промежуток времени практически не меняется или, можно сказать, меняется квазистационарно, т. е.
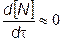 .
.
Тогда из (7.68) и (7.69) имеем
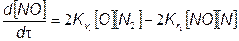 (7.71)
(7.71)
Чтобы рассчитать концентрацию атомов азота, из (7.68) с (7.69) получим уравнение
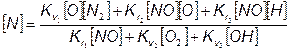 (7.72)
(7.72)
Ясно, что (7.68) и (7.69) кроме концентрации N0 содержат концентрации еще пяти химических компонентов: О,О2, Н, N2, ОН, приводящих к образованию N0, причем они образуются гораздо быстрее, чем N0. Если принять, что для каждого момента времени осуществляется химическое равновесие, то концентрации этих веществ можно вычислить, используя закон действующих масс. Расчет основан на трех химических реакциях окисления:
CO+1/2O2 ↔CO2 H2 +1/2O2↔ H2O OH+1/2O2↔H2O
на двух реакциях диссоциации
Н2↔Н + Н O2↔ O + O (7.74)
с зачетом атомарных давлений 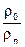 ,
, 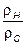 ,
, 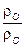 и баланса давлений, согласно закону Дальтона. Систему уравнений (7.73) и (7.74) называют ОНС-системой. Ясно, что кроме указанных выше пяти промежуточных компонентов требуется учитывать изменение концентраций еще четырех реагентов: водяного пара (H2O) ,водорода (H2) диоксида углерода (СО2 )и оксида углерод (СО) а, т.е.девяти компонентов:: Н2О, О2, Н2, СО, СО2, N2, ОН, О, Н.
и баланса давлений, согласно закону Дальтона. Систему уравнений (7.73) и (7.74) называют ОНС-системой. Ясно, что кроме указанных выше пяти промежуточных компонентов требуется учитывать изменение концентраций еще четырех реагентов: водяного пара (H2O) ,водорода (H2) диоксида углерода (СО2 )и оксида углерод (СО) а, т.е.девяти компонентов:: Н2О, О2, Н2, СО, СО2, N2, ОН, О, Н.
Тогда для пяти реакций окисления (7.73) и диссоциации (7.71) константы скорости реакции соответственно равны:
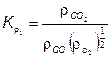
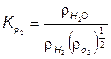
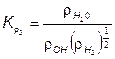 (7.75)
(7.75)
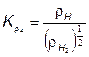
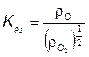
Отношения атомарных давлений можно определить по мулам, предложенным в [25, 30]:
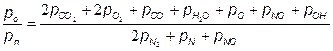
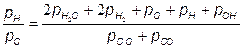
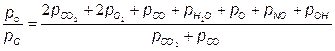
Учитывая, что атмосферный воздух имеет постоянный по объему состав (21 % О2 + 79 % N2), топливо состоит из углеводородов (СmНn), из (7.76) получаем
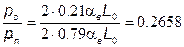
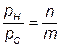
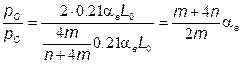
Так можно определить парциальные давления (концентрации) компонентов, участвующих в химических реакциях образования На рис. 7.13 приведен пример изменения концентраций отдельных компонентов в зависимости от температуры. После расчета коннцентраций этих компонентов оксиды азота вычисляют в функциональной зависимости [N0] = Дт) путем решения венного дифференциального уравнения (7.68) или (7.71). приближенной оценки процессов образования N0 вместо изложенного выше, иногда применяют упрощенные подходы. Из них наиболее типичным является подход, базирующийся на пренебрежении влиянием обратных реакций. Из (7.71) следует, что
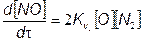
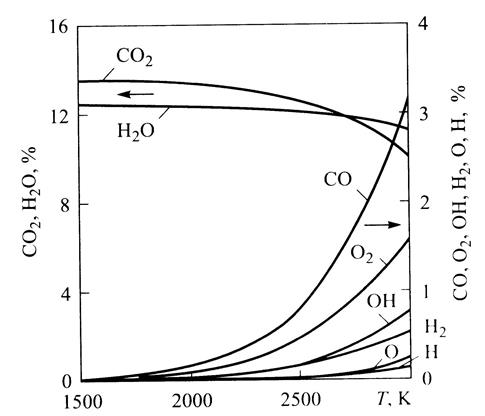
Рис.7.13 Концентрация компонентов ОНС-системы при равновесном процессе
Концентрация кислорода в соответствии с формулой, предложенной Бокхорном [18, 27]:
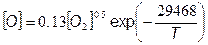
где [О] и [О 2] в кмоль/м3. После подстановки (7.79) в (7.78) с учетом значения 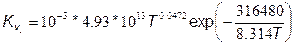 получим
получим
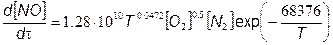
Уравнение (7.80) позволяет только приближенно оценить концентрацию оксида азота, поскольку обычно значения [NО] завышены по сравнению с реальными. Это объясняется тем, что обычные реакции в расширенном механизме Зельдовича (7.65), (7.66)] (7.67), которыми при выводе (7.80) пренебрегают, в реальном случае замедляют процесс образования оксидов азота и в конце рабочего хода поршня приводят к тому, что концентрация [NО], на оборот, понижается.
Для приближенных оценок можно использовать также эмпирическое уравнение
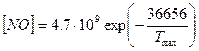
где Ттах — максимальная температура в цилиндре двигателя; в [NО] ррm.
Подчеркнем, уравнения, аналогичные уравнениям (7.80) (7.81), часто встречавшиеся в литературе, получены для определенных конкретных случаев. Они не обобщены для различных двигателей и поэтому пригодны только для приближенной оценочного процесса образования N0 в поршневых двигателях.
На рис. 7.14 приведены диаграммы образования и распада оксида азота в термическом реакторе при значениях р = 60 бар  αв = 1,0 для различных значений температуры. Ясно, что химическое равновесие достигается тем быстрее, чем выше температура. Например, при значении Т = 2400 К за промежуток времени равный 20 мс, а при Т=2800 К равный 3 мс. Однако в поршневых двигателях значение Т=2800 К достигается
αв = 1,0 для различных значений температуры. Ясно, что химическое равновесие достигается тем быстрее, чем выше температура. Например, при значении Т = 2400 К за промежуток времени равный 20 мс, а при Т=2800 К равный 3 мс. Однако в поршневых двигателях значение Т=2800 К достигается
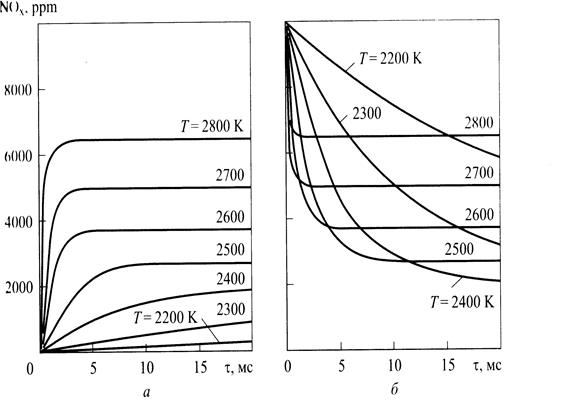
Рис.7.14. ОбразованиеNО(α) и его распад (б) в термическом ре (р = 60 бар, αв =1,0)
непосредственно в фронте пламени в течение короткого промежутка времени поскольку температура в зоне сгоревшей смеси вследствие выгашивания со свежим воздухом быстро подает, вполне возможно, что имеющийся в распоряжении короткий промежуток времени недостаточен для достижения химического равновесия. По образование оксидов азота в процессе сгорания в поршневых двигателях следует рассматривать на основе химической кинетики. При этом необходимо определить локальные нестационарные температуры рабочего тела, используя многозонную модель (см. гл. 3), как, например в [8]. На рис. 7.15 приведены результаты расчета концентрации оксидов азота по локальным температурам средней по объему цилиндра температуре. Из рисунка следует расчет, выполненный на основе многозонной модели, дает хорошее приближение к экспериментальным данным.
В заключение отметим, что в процессе сгорания в поршневых двигателях около 5...10 % суммарных оксидов азота образуются в соответствии с механизмом Фенимора («быстрые» NО) и примерно 90...95 % - Зельдовича ( термические NО ).Это подтверждается результатами исследований( рис.7.16), приведенных в работах21,33, посвященных анализу отдельных механизмов образования оксидов азота в поршневых двигателях.
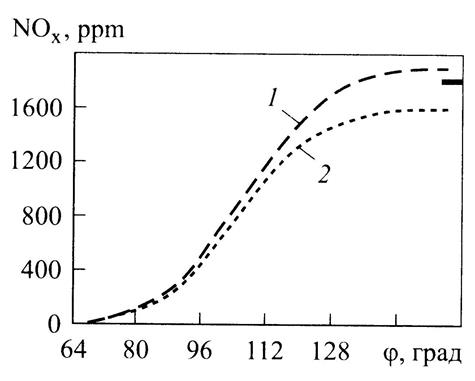
Рис. 7.15.Концентрации оксидов азота (NOх), рассчитанные на осн многозонной модели (1) и по усредненной температуре (2); — опытные данные для двигателя ЯМЗ-7511
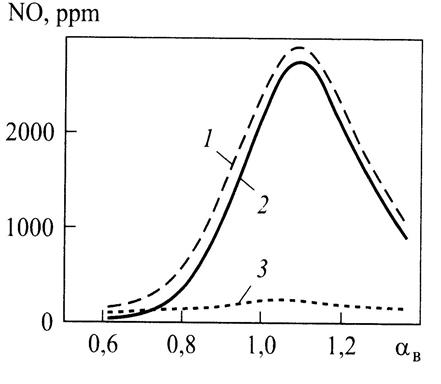
Рис. 7.16. Вклад различных механизмов в образование N0:
----суммарные;--термические;......— «быстрые»
Дата добавления: 2014-12-30; просмотров: 2817;
